Миастения у ребенка симптомы и лечение
Миастенией называют генетически обусловленное или аутоиммунное заболевание, характеризующееся преходящей слабостью и быстрым развитием утомляемости поперечно-полосатых мышц.
Поперечно-полосатыми, или скелетными, называют мышцы, которые сокращаются по желанию человека, обеспечивают движения. К ним относятся, помимо мышц туловища, мимическая мускулатура, глазные мышцы, жевательные. Сердечная мышца по своей структуре тоже поперечно-полосатая, хотя она и не подвластна произвольным сокращениям.
Мышечная слабость при миастении преходящая – она нарастает в процессе движений и уменьшается в покое (после сна, отдыха). Заболевание может развиться в любом возрасте. Средний возраст начала заболевания – около 7 лет. Чаще страдают девочки. Распространенность болезни достигает 5 случаев на 100 тысяч населения, из них детей – до 15 %.
Содержание
- 1 Причины
- 2 Симптомы
- 3 Диагностика
- 4 Лечение
- 5 Питание
- 6 Резюме для родителей
- 7 Причины
- 8 Симптомы
- 9 Диагностика
- 10 Лечение
- 11 Питание
- 12 Резюме для родителей
- 13 1.1 Определение
- 14 1.2 Этиология и патогенез
- 15 1.3 Эпидемиология
- 16 1.4 Кодирование по МКБ-10
- 17 1.5 Примеры диагнозов
- 18 1.6 Классификация
- 19 2.1 Жалобы и анамнез
- 20 2.2 Физикальное обследование
- 21 2.3 Лабораторная диагностика
- 22 2.4 Инструментальная диагностика
- 23 2.5 Иная диагностика
- 24 2.6 Дифференциальная диагностика.
- 25 3.1 Консервативное лечение
- 26 3.2 Хирургическое лечение
- 27 5.1 Профилактика
- 28 5.2 Ведение пациентов
- 29 6.1 Исходы и прогноз
- 30 Что это такое?
- 31 Причины миастении
- 32 Патогенез
- 33 Классификация
- 34 Симптомы
- 35 Миастенический криз
- 36 Диагностика
- 37 Как лечить миастению?
- 38 Профилактика миастении и её осложнений
- 39 Прогноз
- 40 Что такое миастения, причины и основные симптомы
- 41 Миастения у детей
- 42 Формы миастении
- 43 Миастенический криз
- 44 Диагностика
- 45 Методы лечения миастении
- 46 Профилактические меры
- 47 1.1 Определение
- 48 1.2 Этиология и патогенез
- 49 1.3 Эпидемиология
- 50 1.4 Кодирование по МКБ-10
- 51 1.5 Примеры диагнозов
- 52 1.6 Классификация
- 53 2.1 Жалобы и анамнез
- 54 2.2 Физикальное обследование
- 55 2.3 Лабораторная диагностика
- 56 2.4 Инструментальная диагностика
- 57 2.5 Иная диагностика
- 58 2.6 Дифференциальная диагностика.
- 59 3.1 Консервативное лечение
- 60 3.2 Хирургическое лечение
- 61 5.1 Профилактика
- 62 5.2 Ведение пациентов
- 63 6.1 Исходы и прогноз
- 64 Миастения у детей
- 65 Что такое Миастения у детей —
- 66 Что провоцирует / Причины Миастении у детей
- 67 Патогенез (что происходит?) во время Миастении у детей
- 68 Симптомы Миастении у детей
- 69 Диагностика Миастении у детей
- 70 Лечение Миастении у детей
- 71 Профилактика Миастении у детей
- 72 Миастения у детей
- 73 Что такое Миастения у детей —
- 74 Что провоцирует / Причины Миастении у детей:
- 75 Патогенез (что происходит?) во время Миастении у детей:
- 76 Симптомы Миастении у детей:
- 77 Диагностика Миастении у детей:
- 78 Лечение Миастении у детей:
- 79 Профилактика Миастении у детей:
- 80 К каким докторам следует обращаться если у Вас Миастения у детей:
- 81 Миастения у детей
- 82 Миастения у детей
- 83 Ключевые слова
- 84 Список сокращений
- 85 Термины и определения
- 86 1. Краткая информация
- 87 1.1 Определение
- 88 1.2 Этиология и патогенез
- 89 1.3 Эпидемиология
- 90 1.4 Кодирование по МКБ-10
- 91 1.5 Примеры диагнозов
- 92 1.6 Классификация
- 93 2. Диагностика
- 94 2.1 Жалобы и анамнез
- 95 2.2 Физикальное обследование
- 96 2.3 Лабораторная диагностика
- 97 2.4 Инструментальная диагностика
- 98 2.5 Иная диагностика
- 99 2.6 Дифференциальная диагностика.
- 100 3. Лечение
- 101 3.1 Консервативное лечение
- 102 3.2 Хирургическое лечение
- 103 4. Реабилитация
- 104 5. Профилактика и диспансерное наблюдение
- 105 5.1 Профилактика
- 106 5.2 Ведение пациентов
- 107 6. Дополнительная информация, влияющая на течение и исход заболевания
- 108 6.1 Исходы и прогноз
- 109 Критерии оценки качества медицинской помощи
Причины
При миастении нарушается передача нервного импульса с нервного окончания на мышечную клетку.
Основной причиной миастении является блок передачи импульса с нервного окончания на мышцу вследствие нарушения синтеза, выделения или прикрепления ацетилхолина (биологически активного вещества для передачи импульса) на рецепторы мышц.
При аутоиммунном процессе вырабатываются антитела к ацетилхолиновым рецепторам мышц, которые и вызывают нервно-мышечный блок, прекращают передачу импульса.
Причиной возникновения миастении может стать:
- наследственная передача болезни с разным типом наследования (аутосомно-доминантным или аутосомно-рецессивным);
- увеличение (гиперплазия) или опухоли тимуса, то есть вилочковой железы (центрального органа иммунной системы);
- системные заболевания;
- инфекционные болезни;
- гормональные нарушения;
- поражения двигательных нейронов.
Миастения по распространенности мышечного поражения может быть:
- генерализованной;
- локальной (глазной или глоточно-лицевой);
- скелетно-мышечной.
Она может развиваться с нарушением сердечной функции и дыхания или без них. Локальные формы у детей отмечаются в 12 % случаев. Протекают они тяжелее, чем у взрослых. Наиболее тяжелой является генерализованная форма.
У детей различают такие виды миастении:
- врожденная (встречается очень редко);
- неонатальная, или ранняя детская;
- ювенильная (приобретенная) – наиболее распространена, развивается чаще у девочек в период полового созревания.
Преходящий миастенический синдром, или неонатальная миастения, развивается у 10-20 % новорожденных, матери которых болеют миастенией. Это обусловлено преодолением плацентарного барьера материнскими антителами к ацетилхолиновым рецепторам. Проявления миастенического синдрома у таких детей отмечаются на протяжении от 1,5 месяцев до 2 лет.
Миастенический синдром может отмечаться при некоторых состояниях и заболеваниях:
- гипер- и гипотиреоз (повышение или понижение функции щитовидной железы);
- полиомиелит;
- ботулизм;
- снижение (при болезни Аддисона) или повышение (при болезни Иценко-Кушинга) функции коры надпочечников;
- передозировка антибиотиков группы аминогликозидов или фторхинолонов.
Симптомы
Врожденная миастения выявляется у детей уже после рождения, хотя еще на этапе внутриутробного развития можно заметить слабую активность плода.
После рождения младенца проявлениями болезни являются:
- слабый плач;
- затруднение сосания;
- нарушение глотания;
- глазодвигательные нарушения;
- затрудненное дыхание;
- снижение рефлексов.
Из-за нарушения дыхания этот вид миастении у детей часто является причиной летального исхода.
Неонатальная миастения чаще проявляется поражением глазных мышц и дыхательной мускулатуры. Младенец после рождения очень слаб, малоподвижен. В процесс могут вовлекаться жевательные или мимические мышцы. Течение чаще легкое, но возможно прогрессирование болезни с развитием среднетяжелого течения и даже тяжелого. При правильном лечении имеет благоприятный исход.
Первыми проявлениями ювенильной миастении являются:
- ограничение движений глазами;
- возможно косоглазие, двоение в глазах;
- нистагм (непроизвольные подергивания глазных яблок);
- нарушение функции жевательной мускулатуры;
- затруднение глотания;
- поражение мимических мышц (лицо перестает выражать эмоции);
- птоз (опущение) век: одно- или двусторонний;
- неподвижность взгляда;
- невнятная речь.
Все эти симптомы особенно четко заметны вечером – проявляется усталость мышц. Глазные мышцы восстанавливают свои функции после короткого отдыха. Для других мышц необходим более продолжительный отдых.
Вначале может появиться только один признак, а в последующем могут развиваться и другие симптомы. В зависимости от локализации мышечных нарушений различают глазную форму болезни, глоточно-лицевую, скелетно-мышечную.
Наиболее тяжело протекает генерализованная форма ювенильной миастении с поражением мышц всего тела – головы, шеи, конечностей, туловища. Проявлениями ее являются сбои дыхания, сердечной деятельности, нарушение координации движений. Значительная утомляемость мышц отмечается после физической нагрузки у подростков.
Поражение мышц глотки и лица вызывает не только отсутствие мимики, а и нарушение глотания, неподвижность языка и неба, что приводит к нарушению речи, гнусавости, изменению артикуляции даже в конце продолжительного разговора.
Диагностика
Чтобы диагностировать снижение мышечной силы после нагрузки, проводят электромиографию.
Главной задачей является выявление патологической утомляемости мышц, позволяющей заподозрить миастению.
Для подтверждения диагноза проводятся дополнительные исследования:
- прозериновая проба (определение силы мышц перед и после введения в мышцу прозерина);
- сцинтиграфия вилочковой железы;
- КТ или МРТ грудной клетки (для диагностики патологии тимуса) и головного мозга (для выявления поражения гипоталамо-гипофизарной зоны);
- электромиография для выявления снижения силы мышц после нагрузки;
- серологический анализ крови для выявления антител к ацетилхолиновым рецепторам.
Прозериновая проба служит подтверждением миастении, если через полчаса после введения прозерина миастенические симптомы полностью исчезают или их выраженность уменьшается. Сложнее всего диагностировать у детей локальные формы миастении.
Лечение
Лечение миастении может быть консервативным и оперативным.
В качестве консервативного лечения основным является применение антихолинэстеразных препаратов (прозерин, Калимин, Оксазил) в индивидуально подобранной дозировке, которая зависит не только от возраста и формы болезни, а и от результатов пробы с прозерином. Она помогает оценить степень компенсации после введения препарата и выявить его побочные эффекты.
При выборе разновидности антихолинэстеразного препарата врач учитывает фармакокинетику каждого из них:
- прозерин вводится подкожно, действие его начинается спустя 20 минут, с максимальным эффектом примерно через полчаса и длительностью около 3 ч.;
- Калимин для внутреннего приема действует спустя 40-90 мин. и на протяжении 5-6 ч.;
- Оксазил (в таблетках) – действие начинается через 45 минут и продолжается до 6-8 ч.
При миастении с нарушением глотания может использоваться комбинация препаратов: за полчаса до приема пищи вводится прозерин, а через час – Калимин с его продолжительным эффектом.
При передозировке антихолинэстеразных препаратов возможно возникновение холинергического криза, симптомами которого будут:
- сужение зрачков;
- повышение слюновыделения;
- замедление пульса;
- приступообразные боли в животе;
- понос;
- рвота;
- затруднение дыхания из-за бронхоспазма;
- возбуждение ребенка.
В тяжелых случаях передозировки возможны судороги и летальный исход. Родители должны знать о возможных побочных эффектах препаратов и внимательно следить за состоянием ребенка.
Криз может развиваться медленно. При этом в течение нескольких дней отмечается бледность, мраморность кожи, холодные на ощупь конечности. При возникновении симптомов холинергического криза следует без промедления вызвать скорую помощь и госпитализировать ребенка.
Наоборот, при недостаточной дозе антихолинэстеразных препаратов может развиться миастенический криз, при котором ухудшение состояния ребенка связано с усилением симптомов миастении. В лечении используются более высокие дозировки препаратов.
Компонентами консервативной терапии при миастении также могут быть:
- Глюкокортикостероиды (преднизолон и др.) – применяются при тяжелой форме болезни. При этом необходимо принимать препараты калия. И кортикостероиды, и калий усиливают действие антихолинэстеразных препаратов, поэтому их дозы уменьшаются во избежание развития холинергического криза.
- Метод энтеросорбции (с помощью Полифепана), который способствует улучшению нервно-мышечной передачи импульса.
- Используется также плазмаферез, при проведении которого удаляются антитела к ацетилхолиновым рецепторам.
- Иммуноглобулины (Пентаглобин, Интраглобин) для введения в вену.
- Цитостатики (Азатиоприн, Метотрексат) в случае неэффективности гормональной терапии и антихолинэстеразных препаратов.
Оперативное лечение при тяжелой и среднетяжелой миастении у детей – это удаление вилочковой железы (тимэктомия). Эффективность этого метода (улучшение или выздоровление) достигает 70-80 %.
Операция показана при наличии опухоли или кисты в вилочковой железе, при непереносимости или недостаточной эффективности антихолинэстеразных препаратов. На результативность оперативного лечения влияет продолжительность заболевания. При длительности болезни менее 5 лет улучшение после тимэктомии отмечается у 98 % детей.
При неоперабельных опухолях тимуса может применяться лучевая терапия.
Родители также должны знать, что некоторые лекарственные средства могут ухудшать течение миастении.
К таким препаратам относятся:
- антибиотики (тетрациклины, фторхинолоны, аминогликозиды и др.);
- мочегонные;
- обезболивающие;
- противосудорожные;
- слабительные;
- нейролептики;
- транквилизаторы.
Поэтому нельзя (очень опасно!) заниматься самолечением какой-либо патологии у детей с миастенией.
Больному ребенку противопоказаны физические нагрузки, продолжительное пребывание на солнце. Занятия, требующие затраты энергии и сил, лучше выполнять утром, после достаточного отдыха, в период активности.
Питание
Чтобы улучшить возбудимость нервных волокон и сократимость мышц, ребенку, страдающему миастенией, следует употреблять продукты, которые содержат кальций.
В случае поражения жевательной мускулатуры и при нарушении глотания у ребенка следует позаботиться о правильном питании и выборе продуктов. Если во время приема пищи развивается усталость жевательных мышц, то следует предусмотреть более частое кормление малыша с интервалами для отдыха мышц, чтобы избежать развития гипотрофии (недостаточного питания, отставания в весе от возрастных норм).
При поражении мышц, обеспечивающих глотание, прием пищи ребенком должен происходить обязательно в присутствии взрослых. Родители должны уметь оказывать немедленную помощь (прием Геймлиха) в случае поперхивания пищей.
Порядок действий члена семьи при оказании помощи таков:
- Если ребенок маленький, то его быстро укладывают на руку оказывающего помощь (лицом на ладонь, ножки малыша по обе стороны предплечья, ось тельца несколько наклонена книзу).
- Ладонью другой руки нужно похлопывать по межлопаточной области ребенка, пока кусочек пищи не окажется в ладони.
- Если эффект не достигнут, то ребенка укладывают на спину на твердой поверхности. Взрослый встает на колени в ногах ребенка и средними и указательными пальцами рук активно надавливает на живот малыша в подложечной области (между реберными дугами и пупком) по направлению кверху к диафрагме (без сдавливания грудной клетки).
При поперхивании старшего ребенка следует встать у него за спиной (или уложить его на спину в случае потери сознания) и обхватить его руками. Одну свою руку сжать в кулак и положить на живот в подложечной области. Накрыв кулак ладонью другой руки, быстрыми толчкообразными движениями несколько раз надавливать на живот по направлению вверх.
Если дыхательные пути не удалось освободить и дыхание не восстановилось, следует оказывать реанимационные мероприятия (искусственное дыхание методом «рот в рот» и массаж сердца) до приезда скорой помощи.
При выборе продуктов питания для ребенка с миастенией следует обеспечить поступление калия в организм – он улучшает сократительную способность мышц и усиливает действие лекарственных средств при миастении.
Источниками калия могут служить:
- бананы;
- изюм;
- дыня;
- апельсины;
- авокадо;
- печеный картофель;
- красная фасоль и чечевица;
- тыква;
- пастернак;
- брюква.
Не менее важно обеспечить поступление в организм кальция, который участвует в сократимости мышц, повышает возбудимость нервных волокон и укрепляет костную ткань, предотвращая переломы (дети с миастенией более подвержены травматизму).
Кальций содержат:
- молочные продукты;
- капуста (белокочанная и цветная);
- чечевица и спаржа;
- желтки яиц;
- инжир;
- орехи.
В рацион ребенка необходимо включать продукты, содержащие фосфор, который не только будет способствовать усвоению кальция, но и поможет сберечь энергию в клетках.
К фосфорсодержащим продуктам относятся:
- говяжья печень;
- мозги;
- мясо;
- сыр;
- творог;
- яйца;
- рыба;
- перловая и гречневая крупы;
- грецкие орехи.
Вредными при миастении являются продукты, содержащие магний, который вызывает расслабление мышц:
- брокколи;
- кунжут;
- белая фасоль;
- рыба (морской окунь, камбала, треска, карп, скумбрия);
- креветки;
- сушеные абрикосы;
- малина;
- ежевика;
- шпинат.
При лечении кортикостероидами рекомендуется ограничить употребление соли.
Противопоказано употребление продуктов с мочегонным действием, так как они способствуют выведению из организма калия и кальция.
К таким продуктам относятся:
- зеленый чай;
- помидоры;
- огурцы;
- свекла;
- морковь;
- арбузы;
- спаржа;
- редис;
- брюссельская капуста;
- фенхель;
- одуванчик;
- крапива.
При поражении жевательных и глотательных мышц следует готовить для ребенка мягкие продукты, резать пищу небольшими кусочками, которые легче прожевать. Для облегчения глотания можно запивать пищу водой.
Подростки должны знать о категорическом запрете на употребление алкогольных напитков и курение.
Резюме для родителей
Миастения является тяжелым заболеванием, которое может развиваться постепенно. Эффективность лечения зависит от сроков его диагностики. Поэтому заметив утомляемость малыша, лучше проконсультироваться с детским неврологом, а не объяснять мышечную слабость ребенка нежеланием что-либо делать.
Диагностика миастении может потребовать углубленного обследования, консультации многих специалистов. Лечение заболевания зависит от его формы и степени выраженности симптомов.
Познавательное видео о миастении:
Рубрика «PRO здоровье»: что такое миастения?
Миастенией называют генетически обусловленное или аутоиммунное заболевание, характеризующееся преходящей слабостью и быстрым развитием утомляемости поперечно-полосатых мышц.
Поперечно-полосатыми, или скелетными, называют мышцы, которые сокращаются по желанию человека, обеспечивают движения. К ним относятся, помимо мышц туловища, мимическая мускулатура, глазные мышцы, жевательные. Сердечная мышца по своей структуре тоже поперечно-полосатая, хотя она и не подвластна произвольным сокращениям.
Мышечная слабость при миастении преходящая – она нарастает в процессе движений и уменьшается в покое (после сна, отдыха). Заболевание может развиться в любом возрасте. Средний возраст начала заболевания – около 7 лет. Чаще страдают девочки. Распространенность болезни достигает 5 случаев на 100 тысяч населения, из них детей – до 15 %.
Причины
При миастении нарушается передача нервного импульса с нервного окончания на мышечную клетку.
Основной причиной миастении является блок передачи импульса с нервного окончания на мышцу вследствие нарушения синтеза, выделения или прикрепления ацетилхолина (биологически активного вещества для передачи импульса) на рецепторы мышц.
При аутоиммунном процессе вырабатываются антитела к ацетилхолиновым рецепторам мышц, которые и вызывают нервно-мышечный блок, прекращают передачу импульса.
Причиной возникновения миастении может стать:
- наследственная передача болезни с разным типом наследования (аутосомно-доминантным или аутосомно-рецессивным);
- увеличение (гиперплазия) или опухоли тимуса, то есть вилочковой железы (центрального органа иммунной системы);
- системные заболевания;
- инфекционные болезни;
- гормональные нарушения;
- поражения двигательных нейронов.
Миастения по распространенности мышечного поражения может быть:
- генерализованной;
- локальной (глазной или глоточно-лицевой);
- скелетно-мышечной.
Она может развиваться с нарушением сердечной функции и дыхания или без них. Локальные формы у детей отмечаются в 12 % случаев. Протекают они тяжелее, чем у взрослых. Наиболее тяжелой является генерализованная форма.
У детей различают такие виды миастении:
- врожденная (встречается очень редко);
- неонатальная, или ранняя детская;
- ювенильная (приобретенная) – наиболее распространена, развивается чаще у девочек в период полового созревания.
Преходящий миастенический синдром, или неонатальная миастения, развивается у 10-20 % новорожденных, матери которых болеют миастенией. Это обусловлено преодолением плацентарного барьера материнскими антителами к ацетилхолиновым рецепторам. Проявления миастенического синдрома у таких детей отмечаются на протяжении от 1,5 месяцев до 2 лет.
Миастенический синдром может отмечаться при некоторых состояниях и заболеваниях:
- гипер- и гипотиреоз (повышение или понижение функции щитовидной железы);
- полиомиелит;
- ботулизм;
- снижение (при болезни Аддисона) или повышение (при болезни Иценко-Кушинга) функции коры надпочечников;
- передозировка антибиотиков группы аминогликозидов или фторхинолонов.
Симптомы
Врожденная миастения выявляется у детей уже после рождения, хотя еще на этапе внутриутробного развития можно заметить слабую активность плода.
После рождения младенца проявлениями болезни являются:
- слабый плач;
- затруднение сосания;
- нарушение глотания;
- глазодвигательные нарушения;
- затрудненное дыхание;
- снижение рефлексов.
Из-за нарушения дыхания этот вид миастении у детей часто является причиной летального исхода.
Неонатальная миастения чаще проявляется поражением глазных мышц и дыхательной мускулатуры. Младенец после рождения очень слаб, малоподвижен. В процесс могут вовлекаться жевательные или мимические мышцы. Течение чаще легкое, но возможно прогрессирование болезни с развитием среднетяжелого течения и даже тяжелого. При правильном лечении имеет благоприятный исход.
Первыми проявлениями ювенильной миастении являются:
- ограничение движений глазами;
- возможно косоглазие, двоение в глазах;
- нистагм (непроизвольные подергивания глазных яблок);
- нарушение функции жевательной мускулатуры;
- затруднение глотания;
- поражение мимических мышц (лицо перестает выражать эмоции);
- птоз (опущение) век: одно- или двусторонний;
- неподвижность взгляда;
- невнятная речь.
Все эти симптомы особенно четко заметны вечером – проявляется усталость мышц. Глазные мышцы восстанавливают свои функции после короткого отдыха. Для других мышц необходим более продолжительный отдых.
Вначале может появиться только один признак, а в последующем могут развиваться и другие симптомы. В зависимости от локализации мышечных нарушений различают глазную форму болезни, глоточно-лицевую, скелетно-мышечную.
Наиболее тяжело протекает генерализованная форма ювенильной миастении с поражением мышц всего тела – головы, шеи, конечностей, туловища. Проявлениями ее являются сбои дыхания, сердечной деятельности, нарушение координации движений. Значительная утомляемость мышц отмечается после физической нагрузки у подростков.
Поражение мышц глотки и лица вызывает не только отсутствие мимики, а и нарушение глотания, неподвижность языка и неба, что приводит к нарушению речи, гнусавости, изменению артикуляции даже в конце продолжительного разговора.
Диагностика
Чтобы диагностировать снижение мышечной силы после нагрузки, проводят электромиографию.
Главной задачей является выявление патологической утомляемости мышц, позволяющей заподозрить миастению.
Для подтверждения диагноза проводятся дополнительные исследования:
- прозериновая проба (определение силы мышц перед и после введения в мышцу прозерина);
- сцинтиграфия вилочковой железы;
- КТ или МРТ грудной клетки (для диагностики патологии тимуса) и головного мозга (для выявления поражения гипоталамо-гипофизарной зоны);
- электромиография для выявления снижения силы мышц после нагрузки;
- серологический анализ крови для выявления антител к ацетилхолиновым рецепторам.
Прозериновая проба служит подтверждением миастении, если через полчаса после введения прозерина миастенические симптомы полностью исчезают или их выраженность уменьшается. Сложнее всего диагностировать у детей локальные формы миастении.
Лечение
Лечение миастении может быть консервативным и оперативным.
В качестве консервативного лечения основным является применение антихолинэстеразных препаратов (прозерин, Калимин, Оксазил) в индивидуально подобранной дозировке, которая зависит не только от возраста и формы болезни, а и от результатов пробы с прозерином. Она помогает оценить степень компенсации после введения препарата и выявить его побочные эффекты.
При выборе разновидности антихолинэстеразного препарата врач учитывает фармакокинетику каждого из них:
- прозерин вводится подкожно, действие его начинается спустя 20 минут, с максимальным эффектом примерно через полчаса и длительностью около 3 ч.;
- Калимин для внутреннего приема действует спустя 40-90 мин. и на протяжении 5-6 ч.;
- Оксазил (в таблетках) – действие начинается через 45 минут и продолжается до 6-8 ч.
При миастении с нарушением глотания может использоваться комбинация препаратов: за полчаса до приема пищи вводится прозерин, а через час – Калимин с его продолжительным эффектом.
При передозировке антихолинэстеразных препаратов возможно возникновение холинергического криза, симптомами которого будут:
- сужение зрачков;
- повышение слюновыделения;
- замедление пульса;
- приступообразные боли в животе;
- понос;
- рвота;
- затруднение дыхания из-за бронхоспазма;
- возбуждение ребенка.
В тяжелых случаях передозировки возможны судороги и летальный исход. Родители должны знать о возможных побочных эффектах препаратов и внимательно следить за состоянием ребенка.
Криз может развиваться медленно. При этом в течение нескольких дней отмечается бледность, мраморность кожи, холодные на ощупь конечности. При возникновении симптомов холинергического криза следует без промедления вызвать скорую помощь и госпитализировать ребенка.
Наоборот, при недостаточной дозе антихолинэстеразных препаратов может развиться миастенический криз, при котором ухудшение состояния ребенка связано с усилением симптомов миастении. В лечении используются более высокие дозировки препаратов.
Компонентами консервативной терапии при миастении также могут быть:
- Глюкокортикостероиды (преднизолон и др.) – применяются при тяжелой форме болезни. При этом необходимо принимать препараты калия. И кортикостероиды, и калий усиливают действие антихолинэстеразных препаратов, поэтому их дозы уменьшаются во избежание развития холинергического криза.
- Метод энтеросорбции (с помощью Полифепана), который способствует улучшению нервно-мышечной передачи импульса.
- Используется также плазмаферез, при проведении которого удаляются антитела к ацетилхолиновым рецепторам.
- Иммуноглобулины (Пентаглобин, Интраглобин) для введения в вену.
- Цитостатики (Азатиоприн, Метотрексат) в случае неэффективности гормональной терапии и антихолинэстеразных препаратов.
Оперативное лечение при тяжелой и среднетяжелой миастении у детей – это удаление вилочковой железы (тимэктомия). Эффективность этого метода (улучшение или выздоровление) достигает 70-80 %.
Операция показана при наличии опухоли или кисты в вилочковой железе, при непереносимости или недостаточной эффективности антихолинэстеразных препаратов. На результативность оперативного лечения влияет продолжительность заболевания. При длительности болезни менее 5 лет улучшение после тимэктомии отмечается у 98 % детей.
При неоперабельных опухолях тимуса может применяться лучевая терапия.
Родители также должны знать, что некоторые лекарственные средства могут ухудшать течение миастении.
К таким препаратам относятся:
- антибиотики (тетрациклины, фторхинолоны, аминогликозиды и др.);
- мочегонные;
- обезболивающие;
- противосудорожные;
- слабительные;
- нейролептики;
- транквилизаторы.
Поэтому нельзя (очень опасно!) заниматься самолечением какой-либо патологии у детей с миастенией.
Больному ребенку противопоказаны физические нагрузки, продолжительное пребывание на солнце. Занятия, требующие затраты энергии и сил, лучше выполнять утром, после достаточного отдыха, в период активности.
Питание
Чтобы улучшить возбудимость нервных волокон и сократимость мышц, ребенку, страдающему миастенией, следует употреблять продукты, которые содержат кальций.
В случае поражения жевательной мускулатуры и при нарушении глотания у ребенка следует позаботиться о правильном питании и выборе продуктов. Если во время приема пищи развивается усталость жевательных мышц, то следует предусмотреть более частое кормление малыша с интервалами для отдыха мышц, чтобы избежать развития гипотрофии (недостаточного питания, отставания в весе от возрастных норм).
При поражении мышц, обеспечивающих глотание, прием пищи ребенком должен происходить обязательно в присутствии взрослых. Родители должны уметь оказывать немедленную помощь (прием Геймлиха) в случае поперхивания пищей.
Порядок действий члена семьи при оказании помощи таков:
- Если ребенок маленький, то его быстро укладывают на руку оказывающего помощь (лицом на ладонь, ножки малыша по обе стороны предплечья, ось тельца несколько наклонена книзу).
- Ладонью другой руки нужно похлопывать по межлопаточной области ребенка, пока кусочек пищи не окажется в ладони.
- Если эффект не достигнут, то ребенка укладывают на спину на твердой поверхности. Взрослый встает на колени в ногах ребенка и средними и указательными пальцами рук активно надавливает на живот малыша в подложечной области (между реберными дугами и пупком) по направлению кверху к диафрагме (без сдавливания грудной клетки).
При поперхивании старшего ребенка следует встать у него за спиной (или уложить его на спину в случае потери сознания) и обхватить его руками. Одну свою руку сжать в кулак и положить на живот в подложечной области. Накрыв кулак ладонью другой руки, быстрыми толчкообразными движениями несколько раз надавливать на живот по направлению вверх.
Если дыхательные пути не удалось освободить и дыхание не восстановилось, следует оказывать реанимационные мероприятия (искусственное дыхание методом «рот в рот» и массаж сердца) до приезда скорой помощи.
При выборе продуктов питания для ребенка с миастенией следует обеспечить поступление калия в организм – он улучшает сократительную способность мышц и усиливает действие лекарственных средств при миастении.
Источниками калия могут служить:
- бананы;
- изюм;
- дыня;
- апельсины;
- авокадо;
- печеный картофель;
- красная фасоль и чечевица;
- тыква;
- пастернак;
- брюква.
Не менее важно обеспечить поступление в организм кальция, который участвует в сократимости мышц, повышает возбудимость нервных волокон и укрепляет костную ткань, предотвращая переломы (дети с миастенией более подвержены травматизму).
Кальций содержат:
- молочные продукты;
- капуста (белокочанная и цветная);
- чечевица и спаржа;
- желтки яиц;
- инжир;
- орехи.
В рацион ребенка необходимо включать продукты, содержащие фосфор, который не только будет способствовать усвоению кальция, но и поможет сберечь энергию в клетках.
К фосфорсодержащим продуктам относятся:
- говяжья печень;
- мозги;
- мясо;
- сыр;
- творог;
- яйца;
- рыба;
- перловая и гречневая крупы;
- грецкие орехи.
Вредными при миастении являются продукты, содержащие магний, который вызывает расслабление мышц:
- брокколи;
- кунжут;
- белая фасоль;
- рыба (морской окунь, камбала, треска, карп, скумбрия);
- креветки;
- сушеные абрикосы;
- малина;
- ежевика;
- шпинат.
При лечении кортикостероидами рекомендуется ограничить употребление соли.
Противопоказано употребление продуктов с мочегонным действием, так как они способствуют выведению из организма калия и кальция.
К таким продуктам относятся:
- зеленый чай;
- помидоры;
- огурцы;
- свекла;
- морковь;
- арбузы;
- спаржа;
- редис;
- брюссельская капуста;
- фенхель;
- одуванчик;
- крапива.
При поражении жевательных и глотательных мышц следует готовить для ребенка мягкие продукты, резать пищу небольшими кусочками, которые легче прожевать. Для облегчения глотания можно запивать пищу водой.
Подростки должны знать о категорическом запрете на употребление алкогольных напитков и курение.
Резюме для родителей
Миастения является тяжелым заболеванием, которое может развиваться постепенно. Эффективность лечения зависит от сроков его диагностики. Поэтому заметив утомляемость малыша, лучше проконсультироваться с детским неврологом, а не объяснять мышечную слабость ребенка нежеланием что-либо делать.
Диагностика миастении может потребовать углубленного обследования, консультации многих специалистов. Лечение заболевания зависит от его формы и степени выраженности симптомов.
Познавательное видео о миастении:
Рубрика «PRO здоровье»: что такое миастения?
Оглавление Ключевые слова
- Патологическая утомляемость,
- Слабость лицевой мускулатуры,
- Офтальмологические нарушения,
- Бульбарные расстройства,
- Нарушение витальных функций,
- Антихолинэстеразные препараты.
Список сокращений
АХ – ацетилхолин
ГКС — глюкокортикостероиды
Термины и определения
Новые и узконаправленные профессиональные термины в настоящих клинических рекомендациях не используются
1. Краткая информация
1.1 Определение
Миастения – это аутоиммунное заболевание, характеризующееся нарушением нервно-мышечной передачи и проявляющееся слабостью и патологической утомляемостью скелетных (поперечнополосатых) мышц.
1.2 Этиология и патогенез
По современным представлениям, основой патогенеза миастении является аутоиммунная реакция, вызванная связыванием антителами ацетилхолиновых рецепторов (АХР) постсинаптических мембран поперечно-полосатой мускулатуры. Число этих рецепторов значительно снижено под воздействием этих аутоантител. В некоторых случаях при аутоиммунной миастении гравис (МГ) не выявляются антитела (АТ) к АХР, и такая форма получила название серонегативной миастении гравис (СН-МГ). Термин «серонегативная» является неточным по отношению к группе пациентов, включая детей, имеющих АТ класса IgG к мышечной специфической рецепторной тирозинкиназе (МуСК). Эта форма получила название МуСК-МГ. Хотя получены убедительные доказательства патогенности АХР АТ, патогенетическая роль МуСК АТ остается неясной. Могут выявляться и другие АТ, роль которых не установлена, в том числе к титину, рианодиновым рецепторам и внутриклеточному АХР-связанному протеину рапсину.
Механизм, запускающий выработку АТ, остается неизвестным. На роль вилочковой железы указывает сочетание АХР и лимфоидной гиперплазиии опухолей тимуса, а также эффективность тимэктомии. При МуСК-МГ если и выявляются, то лишь небольшие гистологические изменения тимуса. На наличие генетической предрасположенности указывает относительно часто наблюдающиеся клинические и электромиографические (ЭМГ) симптомы у родственников больного и часто встречающиеся отдельные группы антигенов главного комплекса тканевой совместимости человека (HLA).
Отмечается сочетание с другими аутоиммунными расстройствами, особенно с патологией щитовидной железы (гипер- или гипотиреоз), ревматоидным артритом, красной волчанкой и диабетом. По данным некоторых исследователей злокачественные опухоли отмечались у 5% детей.
1.3 Эпидемиология
Миастения — заболевание относительно редкое, хотя существует достаточно оснований считать, что наблюдают его значительно чаще, чем считали ранее. Наиболее предрасположены к заболеванию лица с фенотипом HLA-B3, HLA-B8, HLA-DW3. Распространенность миастении составляет 0,5 – 5 случаев на 100 тыс. населения, однако в настоящее время имеется тенденция к увеличению числа больных и составляет 10 – 24 случая на 100 тыс. населения. Миастения может дебютировать в любом возрасте, начиная с раннего детства (чаще у девочек и в подростковом возрасте) и заканчивая глубокой старостью. Дети и подростки до 17 лет составляют 9-15% больных миастенией. В детском возрасте чаще встречается ювенильная форма миастении. Приблизительно у 5-20% младенцев (по данным разных источников), рожденных больными миастенией матерями, развивается транзиторная неонатальная миастения (ТНМ), обусловленная переносом через плацентарный барьер антител к ацетилхолиновым рецепторам (АХР) от матери. Наиболее высокая заболеваемость отмечается в 2-х возрастных категориях: 20-40 лет (в этот период чаще болеют женщины) и 65-75 лет (в этот период мужчины и женщины поражаются одинаково часто). Средний возраст начала болезни у женщин — 26 лет, у мужчин — 31 год.
1.4 Кодирование по МКБ-10
G70 – Myasthenia gravis и другие нарушения нервно-мышечного синапса: исключены: ботулизм (A05.1), транзиторная неонатальная Myasthenia gravis (P94.0)
G70.0 – Myasthenia gravis
G70.1 — Токсические нарушения нервно-мышечного синапса
G70.2 — Врожденная или приобретенная миастения
G70.8 — Другие нарушения нервно-мышечного синапса
G70.9 — Нарушение нервно-мышечного синапса неуточненное
1.5 Примеры диагнозов
- Миастения, генерализованная форма, прогрессирующее течение, средняя степень тяжести, достаточная компенсация на фоне АХЭП.
- Миастения, локальная (глазная) форма, стационарное течение, легкая степень тяжести, хорошая компенсация на АХЭП.
- Миастения, генерализованная форма с дыхательными нарушениями, прогрессирующее тяжелое течение с недостаточной компенсацией на АХЭП.
1.6 Классификация
Существует несколько классификаций миастении. Наиболее распространена в мире классификация по Оссерману (принята как международная в 1959г. в Лос-Анжелесе, модифицирована в 1971г. Оссерманом и Дженкиным).
Генерализованная миастения:
- Миастения новорожденных
- Врожденная миастения
- Доброкачественная с офтальмопарезом или офтальмоплегией
- Семейная детская
- Юношеская миастения
Глазная миастения:
- Юношеская
- Взрослая
В.С. Лобзиным в 1960г. предложена классификация миастении по течению патологического процесса:
1 – острое начало с быстрым развитием симптомокомплекса и в дальнейшем медленное прогрессирование,
2 – острое начало, более длительное (от 3 месяцев до 1 года) развитие синдрома, течение с ремиссиями, но неуклонным прогрессирование,
3 – постепенное начало, медленное развитие на протяжении нескольких лет и последующее медленно прогрессирующее течение,
4 – начало с ограниченной группы мышц и медленное прогрессирование.
В 1965 г. А.Г. Пановым, Л.В. Довгелем и В.С. Лобзиным разработана классификация миастении по локализации патологического процесса с учетом нарушения витальных функций (нарушением дыхания и сердечной деятельности):
1 — генерализованная:
а) без нарушения витальных функций, б) с нарушением дыхания и сердечной деятельности;
2 — локальная:
а) лицевая форма (глазная, глоточно-лицевая), б) скелетно-мышечная форма: без нарушения дыхания и с нарушением дыхания.
Наиболее удобна для практического врача классификация, предложенная в 1965 г. Б.М. Гехтом. В ней учитывается характер течения заболевания, степень генерализации миастенического процесса, тяжесть двигательных расстройств и степень их компенсации на фоне ингибиторов ацетилхолинэстеразы (АХЭ), что помогает достаточно полно и точно сформулировать диагноз.
По характеру течения:
1. Миастенические эпизоды (однократный или ремиттирующее течение) – преходящие двигательные нарушения с полным регрессом (10-12%).
2. Миастенические состояния (т.е. стационарное течение) – стационарная непрогрессирующая форма в течение многих лет (13%).
3. Прогрессирующее течение – неуклонное прогрессирование заболевания (50-48%).
4. Злокачественная форма – острое начало и быстрое нарастание нарушения функции мышц (25%).
Формы переходят друг в друга.
По локализации:
– локальные (ограниченные) процессы: глазные, бульбарные, лицевые, краниальные, туловищные;
– генерализованные процессы: генерализованные без бульбарных нарушений, генерализованные и генерализованные с нарушением дыхания.
По степени тяжести двигательных расстройств:
— легкая
— средней тяжести
— тяжелая
По степени компенсации двигательных нарушений на фоне ингибиторов ацетилхолинэстеразы (АХЭ):
— полная,
— достаточная,
— недостаточная (плохая).
2. Диагностика
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб обращают внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных или полных ремиссий, обратимость симптомов на фоне приема ингибиторов АХЭ (на время их действия) и на фоне адекватной иммуносупрессивной терапии.
2.2 Физикальное обследование
Клинический осмотр должен включать исследование общего неврологического статуса, а также проверку силы произвольных мышц лица, шеи, туловища и конечностей до и после нагрузки (оценка силы в баллах, где 0 – отсутствие силы, 5 – сила данной группы мышц здорового человека). Одним из самых важных клинических тестов для диагностики миастении является наличие синдрома патологической мышечной утомляемости: нарастание симптомов после нагрузки. Например, нарастание птоза, глазодвигательных нарушений при фиксации взора, после зажмуривания; снижение силы в отдельных группах мышц после повторных активных движений в исследуемой конечности, приседаний или ходьбы; появление или нарастание речевых нарушений при счете, чтении вслух и т.д. При этом не выявляется никаких симптомов органического поражения нервной и нервно-мышечной системы (при отсутствии сопутствующих заболеваний): нет нарушений в рефлекторной и координаторной сфере, сохранена чувствительность, в типичных случаях отсутствуют мышечные атрофии, сохранен мышечный тонус.
Ювенильная аутоиммунная миастения гравис (ЮМГ)
Симптомы болезни могут развиваться в любом возрасте старше одного года, но наиболее часто проявляются у девочек в подростковом возрасте. Начало болезни может быть постепенным или внезапным.
Клиническая картина характеризуется:
- поражением глазодвигательных мышц с диплопией, офтальмоплегией и птозом (могут быть симметричными, асимметричными или односторонними),
- слабость мышц лица (особенно круговой мышцы глаза),
- слабость проксимальных отделов конечностей,
- поражение дыхательной и ротоглоточной мускулатуры,
- глубокие сухожильные рефлексы сохранены.
При обследовании детей с развившейся дыхательной недостаточностью при отсутствии легочной патологии необходимо учитывать возможность ЮМГ, даже если отсутствуют другие симптомы этого заболевания.
Первоначально мышечная сила может быть нормальной или почти нормальной, и поэтому мышечную силу нужно оценивать до и после физической нагрузки.
Частота случаев, при которых поражение ограничено только глазодвигательными мышцами (глазная миастения), существенно отличается в различных публикациях, но, вероятно, составляет 20-50%, и до 80% у маленьких детей в Китае. МуСК-МГ чаще встречается у женщин, в клинической картине преобладает слабость глазодвигательных мышц и мышц черепа, отмечаются частые респираторные кризы. Различия между МуСК-МГ и АХР-МГ еще предстоит выяснить.
Транзиторная неонатальная форма (миастения новорожденных)
Клинические проявления включают:
- общую мышечную гипотонию,
- слабый крик,
- затрудненное дыхание и сосание,
- возможно развитие птоза,
- амимии, глазодвигательных нарушений,
- расстройств глотания, снижение глубоких рефлексов.
Врожденные миастенические синдромы более подробно представлены в приложении Г1.
Преходящий миастенический синдром, проявляющийся у таких детей в первые дни жизни и продолжающийся в течение 1-1,5 мес., обусловлен переносом через плацентарный барьер антител к АХР от матери.
- сопутствующими заболеваниями, и являются отличительным признаком состояния, называемого сейчас ВМС с эпизодическим апноэ).
Таким образом, отличием всех симптомов миастении является динамичность в течение суток, усиление после нагрузки, обратимость или уменьшение степени их выраженности после отдыха.
Миастенический криз, при котором по разным причинам происходит резкое ухудшение состояния с нарушением витальных функций. Молекулярной основой миастенического криза, вероятно, является резкое уменьшение количества функционирующих АХР вследствие массированной атаки их аутоантителами. Часто миастенический криз провоцируется бронхолегочной инфекцией, а в ряде случаев на фоне криза развивается пневмония, и тогда нарушения дыхания могут носить смешанный характер.
Дифференцировать миастенический криз от других тяжелых состояний, сопровождающихся респираторными расстройствами, можно по наличию:
- бульбарного синдрома,
- гипомимии,
- птоза,
- асимметричного наружного офтальмопареза,
- слабости и утомляемости мышц конечностей и шеи (уменьшающихся в ответ на введение ингибиторов АХЭ).
Следует отличать миастенический криз от холинергического (Приложение Г2), который развивается при избыточной дозе ингибиторов АХЭ. Общими симптомами кризов является выраженная слабость произвольной мускулатуры с нарушением дыхания и бульбарным синдромом, психомоторное возбуждение и нарушение сознания (сопор, кома).
Смешанные (миастенический + холинергический) кризы встречаются у больных миастенией при неправильном приеме и / или изначально узком диапазоне терапевтических доз ингибиторов АХЭ, а также на фоне состояний, вызывающих общую или мышечную слабость различного генеза (интеркуррентные инфекции, соматические, гормональные нарушения, прием препаратов, влияющих на сократительную функцию произвольных мышц и др.).
2.3 Лабораторная диагностика
(Сила рекомендаций – 1; достоверность доказательств – С)
- Рекомендуется определение антихолинэстеразных антител.
Комментарии: Антитела к АХР выявляются у детей в пределах 60-80%. В препубертатном возрасте тест положителен примерно у 50% детей. Титр антител снижается у успешно пролеченных пациентов. Из серонегативных на антитела к АХР, около 40-50% серонегативны на антитела к МуСК. Более высокая частота наличия этих антител у детей точно не установлена, но они могут присутствовать при начале заболевания в раннем детском возрасте.
2.4 Инструментальная диагностика
- Рекомендуется проведение итерационной стимуляции нерва (ИСН), что позволяет выявить электрическую нервно-мышечную блокаду.
(Сила рекомендаций – 1; достоверность доказательств – С)
Комментарии: Этот тест вызывает стресс, особенно у маленьких детей, и поэтому должен выполняться щадяще. Технические трудности у маленьких детей также составляют проблему, и поэтому перед тем, как объявлять тест положительным, нужно быть полностью уверенным, что снижение амплитуды происходит по миастеническому типу. Суммарные потенциалы действия мышцы фиксируются с поверхностных электродов, лучше над слабой мышцей; частота стимуляции нерва 3Гц и 5Гц. Снижение амплитуды более чем на 10% в промежутке с третьего по пятый потенциал считается положительным результатом. Одноволоконная ЭМГ, позволяющая выявить усиленное «дрожание» при сокращении пар волокон, является более чувствительным, чем классическая ИСН, но трудновыполнимым у детей методом. Нормальная ИСН не исключает диагноза ЮМГ.
- Рекомендуется в диагностически сложных случаях проводится морфологическое исследование мышечного биоптата (световая, электронная микроскопия, гистохимическое, иммуногистохимическое, иммунофлуоресцентное и другие виды визуального изучения нервно-мышечного соединения и окружающих его тканей).
Комментарии: Основные качественные и количественные изменения при миастении обнаруживаются в постсинаптической мембране, которая содержит АХР, и в стадии развернутой клинической картины число АХР снижается до 10-30% от нормальных значений, падает их плотность.
2.5 Иная диагностика
(Сила рекомендаций – 1; достоверность доказательств – С)
- Рекомендуется применение антихолинэстеразных препаратов — проба с ингибиторами АХЭ: неостигминаметилсульфат (код АТХ: N07AA01), пиридостигмина гидрохлорид (код АТХ: N07AA02). После введения одного из этих препаратов эффект наблюдается в одной или нескольких ослабленных мышцах. Наиболее часто проводится проба с неостигминаметилсульфатом. Доза подбирается индивидуально из расчета 0,125 мг/кг массы тела (ориентировочно: 1,5мл 0,05% раствора – при массе тела до 70кг и 2мл – при массе тела более 70кг или при выраженной генерализованной слабости мышц конечностей без учета массы тела). Можно избрать любой парентеральный путь введения препарата, но обычно делается подкожная инъекция. Оценивается действие препарата через 30-40 минут.
Комментарии: Положительной полной проба считается при восстановлении мышечной силы до 5 баллов с компенсацией бульбарных и глазодвигательных нарушений, положительной неполной – при нарастании силы на 1-2 балла, но без полного ее восстановления и (или) сохранении редуцированного бульбарного или глазодвигательного дефекта. Частичная компенсация заключается в избирательном действии ингибиторов АХЭ на отдельные группы мышц, как правило, с нарастанием силы произвольных мышц на 1балл. Выделяется сомнительная прозериновая проба, когда отмечается некоторая положительная динамика в отношении отдельных симптомов (уменьшение птоза на 1-2мм, некоторое увеличение объема движений глазных яблок, несколько более звонкий голос, впечатление о некотором нарастании силы мышц конечностей и т.д.
- Рекомендуется введение внутримышечное или подкожное неостигмина метилсульфата при подозрении на транзиторную неонатальную форму (миастения новорожденных).
Комментарии: Клинические симптомы позволяют поставить правильный диагноз, если известно о существовании миастении у матери, но заболевание матери может быть недиагностированным или протекать бессимптомно. Диагноз подтверждается при внутримышечном или подкожном введении Неостигмина метилсульфата (Код АТХ: N07AA01); ИСН также может выполняться для подтверждения диагноза, но ее проведение в этом возрасте технически затруднительно и болезненно. Для диагностики, а затем и для лечения, предпочтительнее применять Неостигмина метилсульфат (код АТХ: N07AA01, Прозерин), особенно перед кормлением, так как его эффект продолжается дольше, что дает больше времени для обследования (например, разовая доза 0,1 мг перед кормлением, а дополнительные дозы — по мере необходимости).
Если диагноз миастении вызывает сомнения, требуется динамическое наблюдение, проведение пробного курса ингибиторов АХЭ ( пиридостигмина гидрохлорид в сочетании с препаратами калия – только строго избегая холинергических реакций), повторное клиническое и электромиографическое (ЭМГ) обследование.
Антихолинэстеразный тест и ИСН не обладают высокой чувствительностью и специфичностью, тогда как наличие антител к АХР специфично для миастении гравис.
2.6 Дифференциальная диагностика.
Диагноз миастения ставится на основании совокупности клинических данных, результатов инструментальных обследований. Главное отличие миастении от других форм патологии — динамичность симптомов и положительная реакция на введение антихолинэстеразных препаратов.
Необходимо исключение следующих заболеваний:
— эндокринная офтальмопатия;
— окулофарингеальная мышечная дистрофия;
— рассеянный склероз;
— синдром Фишера;
— ботулизм;
— синдром Толосы-Ханта;
— митохондриальные цитопатии;
— конгенитальные миастенические синдромы и др.
Бульбарные проявления миастении следует дифференцировать с сосудистыми и опухолевыми поражениями мозга, для которых типичны выраженные общемозговые симптомы, а также отсутствие динамичности нарушений и реакции на введение антихолинэстеразных препаратов.
Иногда значительные трудности возникают при дифференциальной диагностике миастении и бокового амиотрофического склероза (БАС), при котором в некоторых случаях возможны не только клинические симптомы миастении, но и нарушения нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. В таких случаях правильный диагноз можно поставить только после проведения ЭМГ, выявляющей признаки денервации и реиннервации, а также наличие большого количества потенциалов фасцикуляций, характерных для БАС. Дыхательные расстройства и кризы при миастении следует дифференцировать с синдромом Гийена-Барре (СГБ), для которого характерна арефлексия, нарушение состава ликвора, отсутствие нарушений нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов.
Слабость мышц туловища и конечностей у больных миастенией дифференцируют с различными формами врождённых и приобретённых миопатий.
Миопатический процесс, как правило, характеризуется отличным от миастении характером распределения двигательных расстройств: отсутствием (за редким исключением) признаков поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; чаще сопровождается снижением или отсутствием сухожильных рефлексов, различной степенью выраженности мышечных атрофий.
Клинические симптомы, напоминающие миастению, возможны и при других формах нарушения нервно-мышечной передачи, таких, как синдром Ламберта-Итона и ботулизм. И если для синдрома Ламберта-Итона не типичны экстраокулярные, бульбарные и дыхательные нарушения, то именно они составляют основное клиническое ядро ботулизма. Характерные для синдрома Ламберта-Итона слабость и утомляемость мышц туловища и конечностей при ботулизме выявляют относительно редко. Для обеих форм характерна гипо- или арефлексия.
Эффект от введения антихолинэстеразных препаратов при синдроме Ламберта-Итона минимальный, а при ботулизме отсутствует. Нарушения нервно-мышечной передачи характеризуются снижением исходной амплитуды М-ответа и её существенным увеличением в процессе высокочастотной стимуляции (инкремент) или после максимального произвольного усилия.
3. Лечение
3.1 Консервативное лечение
- Рекомендовано применение блокаторов холинэстеразы.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Эти препараты увеличивают период полураспада выброшенного в синаптическую щель ацетилхолина (АХ) путем ингибирования его гидролиза ацетилхолинэстеразой, увеличивая таким образом вероятность того, что молекулы АХ достигнут рецепторов, число которых снижено.
- Пиридостигмина бромидж, вк (код ATX:N07AA02) в дозе до 7 мг/кг/день назначается в 3-5 приемов.
- Неостигмина метилсульфатж, вк (код АТХ:N07AA01) начальная доза составляет 0,2-0,5 мг/кг каждые четыре часа у детей до 5 лет и 0,25 мг/кг у более старших детей, максимальная разовая доза 15 мг.
- Рекомендовано применение кортикостероидов.
(Сила рекомендаций – 2; достоверность доказательств – В)
Комментарии: ГКС вызывают ремиссию у большинства детей с ЮМГ. Преднизолон ж ,вк (код АТХ: Н02АВ06) назначается в дозе 1-2 мг/кг/день до достижения устойчивого эффекта, после чего препарат постепенноотменяют.
- Рекомендовано применение других видов длительной иммунотерапии.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии:
- Азатиоприн ж ,вк (код АТХ:L04АХ01) можно применять в комбинации со стероидами или отдельно. Начальная доза 50 мг/сутки и до 100–200 мг/сутки вместе с поддерживающей дозой Преднизолона.
- Циклоспоринж (код АТХ: L04AD01) можно назначать при непереносимости Азатиоприн.
- Циклофосфамид ж, вк (Код АТХ: L01AA01) применяется при очень тяжелом течение болезни.
- Пульс-терапия высокими дозами Метилпреднизолона ж ,вк (H02AB04) применяется у детей с рефрактерным течением болезни.
- Рекомендовано применение замещения плазмы.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Плазмаферез применяется для лечения миастенических кризов, а также для пре- и после операционной поддержки. Проводится внутривенное введение иммуноглобулинов класса G – иммуноглобулин человека нормальный ж ,вк (код АТХ: J06BA02, Иммуноглобулин человека нормальный) Эффект наблюдается через 3-4 дня и сохраняется до 3-х месяцев.
3.2 Хирургическое лечение
- Рекомендовано применение тимэктомии.
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: применяется в качестве основного метода длительного лечения, особенно у детей с высоким риском развития осложнений лечения блокаторами ХЭ или кортикостероидами, либо других видов иммунотерапии.
Показаниями к оперативному лечению являются:
а) злокачественные формы;
б) прогрессирующая форма;
в) миастеническое состояние в зависимости от степени выраженности дефекта.
При локальных формах к оперативному лечению подходят избирательно.
Противопоказания к тимэктомии:
- тяжелые декомпенсированные соматические заболевания;
До оперативного лечения обязательна предоперационная подготовка:
- общеукрепляющая терапия;
- проведение лечебного плазмафереза;
- при необходимости — курс глюкокортикостероидной терапии.
4. Реабилитация
Не требуется
5. Профилактика и диспансерное наблюдение
5.1 Профилактика
Профилактика не разработана.
5.2 Ведение пациентов
Ведение пациентов с миастенией в амбулаторно-поликлинических условиях должно включать:
- ЭКГ всем детям 1 раз в 3 месяц.
- ?УЗИ брюшной полости, сердца, почек – 1 раз в 6 месяц.
- ?рентгенологическое обследование грудной клетки, суставов, при необходимости позвоночника, крестцово-подвздошных сочленений — 1 раз в 6 месяц.
- ?эзофагогастродуоденоскопия с биопсией на Helicobacter pylori и морфологической диагностикой — 1 раз в 6 месяцев для исключения эрозивных, язвенных процессов и гастропатий.
- ?при обострении — УЗИ внутренних органов и рентгенография органов грудной клетки, ЭКГ и другие необходимые инструментальные методы обследования (КТ, МРТ) по показаниям:
- пациентам с миастенией реакция Манту проводится, обследование на туберкулез осуществляется под контролем фтизиатра
- при выявлении положительных туберкулиновых проб (папула > 5 мм) направление на консультацию к врачу – фтизиатру для решения вопроса о проведения Диаскин-теста или туберкулиновых проб с разведением и проведении специфической терапии
Ведение пациента, получающего иммуносупрессивную терапию
- осмотр врача-невролога – 1 раз в месяц;
- ?клинический анализ крови (концентрация гемоглобина, число эритроцитов, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) — 1 раз в 2 недели;
- ?при снижении числа лейкоцитов, эритроцитов, тромбоцитов ниже нормы — иммунодепрессанты отменить на 5–7 дней. После контрольного анализа крови при нормализации показателей — возобновить прием препарата;
- ?анализ биохимических показателей (общий белок, белковые фракции, концентрация мочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) — 1 раз в 2 неделю:
- при повышении уровня мочевины, креатинина, трансаминаз, билирубина выше нормы — иммунодепрессанты отменить на 5–7 дней. Возобновить прием препарата после восстановления биохимических показателей;
- ?анализ иммунологических показателей (концентрация Ig A, M, G; СРБ, РФ, АНФ) —1 раз в 3 месяца.
Ведение пациента с миастенией, получающего антихолинэстеразные препараты
- ?осмотр врача невролога 1 раз в месяц;
- ? клинический анализ крови (концентрация гемоглобина, число эритроцитов, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) — 1 раз в 2 недели;
- ?анализ биохимических показателей (общий белок, белковые фракции, концентрация мочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) — 1 раз в 2 недели;
- ? анализ иммунологических показателей (концентрация Ig A, M, G; СРБ, РФ, АНФ) —1 раз в 3 месяца;
- плановая госпитализация 2 раза в год для проведения полного обследования и при необходимости коррекции терапии.
Пациентам с миастенией показано оформление статуса «ребенок – инвалид». В периоды обострения болезни необходимо обеспечение обучения на дому. В стадии ремиссии болезни рекомендуются занятия ЛФК со специалистом, знакомым с особенностями патологии. При посещении школы? занятия физкультурой в общей группе не показаны. Больным миастенией противопоказаны профилактические прививки, введение ? глобулина.
Пациенты с диагнозом миастения должны находиться под постоянным диспансерным наблюдением педиатра и невролога. Детям с данной патологией показано комплексное обследование в условиях специализированного круглосуточного/дневного стационара, средняя продолжительность госпитализации – 21 день. Целесообразно проведение курсов реабилитационной терапии сроком не менее 21-28 дней 2-3 раза в год под наблюдением невропатолога, врача-физиотерапевта и специалиста ЛФК.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Исходы и прогноз
Наиболее тяжелое течение миастении наблюдается у детей с множественными стигмами дисэмбриогенеза (костно-мышечные дисплазии, аномалии развития центральной нервной системы), нейроэндокринными нарушениями (диэнцефально-височные пароксизмальные состояния, задержка роста и полового созревания на фоне гипопитуитарного синдрома, приобретенный гирсутизм и другие), незрелостью лимфоидной системы носоглотки (аденоиды, тонзиллит, фарингит), бронхообструктивным синдромом и другой сопутствующей патологией. У мальчиков с дебютом заболевания в препубертатный период и регрессом симптомов миастении к концу пубертата, как правило, отмечаются стойкие ремиссии.
Выбор правильной тактики лечения позволяет достигнуть положительного эффекта (стойкая полная или частичная ремиссия на фоне приема медикаментозных средств или без них) у 80 % больных миастенией. Однако, до настоящего времени не существует методов прогноза течения заболевания и специфических патогенетических методов лечения миастении.
Критерии оценки качества медицинской помощи
Таблица 1 — Организационно-технические условия оказания медицинской помощи.
|
Вид медицинской помощи |
Специализированная медицинская помощь |
|
Условия оказания медицинской помощи |
Стационарно / в дневном стационаре |
|
Форма оказания медицинской помощи |
Плановая |
Таблица 2 — Критерии качества оказания медицинской помощи
|
№ |
Критерий |
Уровень достоверности доказательств |
Сила рекомендации |
|
|
Выполнено определение антихолинэстеразных антител, проба с ингибиторами АХЭ |
С |
|
|
|
Выполнено проведение итерационной стимуляции нерва |
С |
|
|
|
Выполнено применение блокаторов холинэстеразы (при отсутствии медицинских противопоказаний) |
В |
|
|
|
Проведена иммуносупрессивная терапиия глюкокортикостероидами (при отсутствии медицинских противопоказаний) |
В |
Список литературы
- Аутоиммунные болезни нервно-мышечной передачи. В кн.: Краткий справочник невролога. – М.: «АБВ-пресс», 2015. – С. 129-139.
- Гузева В.И., Чухловина М.Л. Клинические рекомендации по диагностике и лечению миастении у детей. В книге: Детская неврология. Выпуск 1: клинические рекомендации/ под ред. В.И. Гузевой. – М.: ООО «МК», 2014. – С. 101-127.
- Санадзе А.Г. Миастения. В кн.: Аутоиммунные заболевания в неврологии. Под. ред. Завалишина И.А., Пирадова М.А., Бойко А.Н., Никитина С.С., Спирина Н.Н., Переседовой А.В. Клиническое руководство. – Т.2. – М.: РООИ «Здоровье человека», 2014. – С. 101-128.
- Айкарди Ж. Заболевания нервной системы у детей. — Т.2. – М.: Бином, 2013. – С. 940-949.
- Санадзе А.Г. Миастения и миастенические синдромы. М.: Литтерра, 2012. – 256 с.
- Супонева Н.А., Пирадов М.А. Миастения гравис. В кн.: Внутривенная иммунотерапия в неврологии. М: Горячая линия-Телеком, 2013. – С. 165-191.
- Kaminski H.J. Myasthenia gravis. In book: Neuromuscular disorders in clinical practice (Eds. Katirji B., Kaminski H.J., Ruff R.L.). – New York: Springer, 2014. – P. 1075-1088.
- Parr J., Jayawant S., Buckley C., Vincent A. Childhood autoimmune myasthenia. In book: Inflammatory and autoimmune disorders of the nervous system in children (Eds. Dale R.C., Vincent A.). London: Mac Keith Press, 2010. – P. 388-405.
Приложение А1. Состав рабочей группы
Баранов А.А., акад. РАН, профессор, д.м.н., Председатель Исполкома Союза педиатров России.
Намазова-Баранова Л.С., акад. РАН, профессор, д.м.н., заместитель Председателя Исполкома Союза педиатров России.
Куренков А.Л., профессор, д.м.н., член Союза педиатров России
Кузенкова Л.М., профессор, д.м.н., член Союза педиатров России
Гольцова Н.В., к.м.н., член Союза педиатров России
Мамедъяров А.М., к.м.н., член Союза педиатров России
Бурсагова Б.И., к.м.н., член Союза педиатров России
Вишнева Е.А., к.м.н., член Союза педиатров России
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-педиатры, врачи-неврологи;
- Врачи-ортопеды;
- Врачи-ЛФК, врачи-физиотерапевты,
- Врачи общей практики (семейные врачи);
- Студенты медицинских ВУЗов;
- Обучающиеся в ординатуре и интернатуре.
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска — 5 лет.
Методы, использованные для оценки качества и силы доказательств:
- консенсус экспертов;
- оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
- обзоры опубликованных мета-анализов;
- систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Рекомендуемая доброкачественная практика базируется на клиническом опыте авторов разработанных рекомендаций.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций
- Внешняя экспертная оценка.
- Внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций.
От врачей первичного звена получены комментарии в отношении доходчивости изложения данных рекомендаций, а также их оценка важности предлагаемых рекомендаций, как инструмента повседневной практики.
Все комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы (авторами рекомендаций). Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован независимыми экспертами, которых, прежде всего, попросили прокомментировать доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Основные рекомендации
Сила рекомендаций (1-2) на основании соответствующих уровней доказательств (А-С).
Таблица П1 — Схема для оценки уровня рекомендаций
|
Степень достоверности рекомендаций |
Соотношение риска и преимуществ |
Методологическое качество имеющихся доказательств |
Пояснения по применению рекомендаций |
|
1А Сильная рекомендация, основанная на доказательствах высокого качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот |
Надежные непротиворечивые доказательства, основанные на хорошо выполненных РКИ или неопровержимые доказательства, представленные в какой-либо другой форме. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Сильная рекомендация, которая может использоваться в большинстве случаев у преимущественного количества пациентов без каких-либо изменений и исключений |
|
1В Сильная рекомендация, основанная на доказательствах умеренного качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот |
Доказательства, основанные на результатах РКИ, выполненных с некоторыми ограничениями (противоречивые результаты, методологические ошибки, косвенные или случайные и т.п.), либо других веских основаниях. Дальнейшие исследования (если они проводятся), вероятно, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. |
Сильная рекомендация, применение которой возможно в большинстве случаев |
|
1С Сильная рекомендация, основанная на доказательствах низкого качества |
Польза, вероятно, будет превалировать над возможными рисками и затратами, либо наоборот |
Доказательства, основанные на обсервационных исследованиях, бессистемном клиническом опыте, результатах РКИ, выполненных с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. |
Относительно сильная рекомендация, которая может быть изменена при получении доказательств более высокого качества |
|
2А Слабая рекомендация, основанная на доказательствах высокого качества |
Польза сопоставима с возможными рисками и затратами |
Надежные доказательства, основанные на хорошо выполненных РКИ или подтвержденные другими неопровержимыми данными. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Слабая рекомендация. Выбор наилучшей тактики будет зависеть от клинической ситуации (обстоятельств), пациента или социальных предпочтений. |
|
2В Слабая рекомендация, основанная на доказательствах умеренного качества |
Польза сопоставима с рисками и осложнениями, однако в этой оценке есть неопределенность. |
Доказательства, основанные на результатах РКИ, выполненных с существенными ограничениями (противоречивые результаты, методологические дефекты, косвенные или случайные), или сильные доказательства, представленные в какой-либо другой форме. Дальнейшие исследования (если они проводятся), скорее всего, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. |
Слабая рекомендация. Альтернативная тактика в определенных ситуациях может явиться для некоторых пациентов лучшим выбором. |
|
2С Слабая рекомендация, основанная на доказательствах низкого качества |
Неоднозначность в оценке соотношения пользы, рисков и осложнений; польза может быть сопоставима с возможными рисками и осложнениями. |
Доказательства, основанные на обсервационных исследованиях, бессистемного клинического опыта или РКИ с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. |
Очень слабая рекомендация; альтернативные подходы могут быть использованы в равной степени. |
*В таблице цифровое значение соответствует силе рекомендаций, буквенное — соответствует уровню доказательности
Актуализация данных клинических рекомендаций будет проводиться не реже, чем один раз в три года. Принятие решения об обновлении будет принято на основании предложений, представленных медицинскими профессиональными некоммерческими организациями с учётом результатов комплексной оценки лекарственных препаратов, медицинских изделий, а также результатов клинической апробации.
Приложение А3. Связанные документы
Порядки оказания медицинской помощи: Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи»
Стандарты оказания медицинской помощи: Приказ Министерства здравоохранения РФ от 24.12.2012 N 1538н «Об утверждении стандарта специализированной медицинской помощи при тяжелой миастении, осложненной кризом» (Зарегистрировано в Минюсте России 13 марта 2013 N 27646)
Приложение Б. Алгоритмы ведения пациента
|
Пациент с подозрением на миастению |
|
Консультация профильного специалиста |
|
Диагноз подтвержден по Подтвержден? |
НЕТ
|
Лечение блокаторами АХЭ в стационаре |
ДА
|
Диспансерное наблюдение и АХЭ терапия |
ДА
НЕТ
|
Показана коррекция АХЭ терапии |
Приложение В. Информация для пациентов
Миастения – тяжелое аутоиммунное нервно-мышечное заболевание с прогрессирующим течением, клинически проявляющееся патологической мышечной утомляемостью, приводящей к парезам и параличам. Иммунологические нарушения при миастении имеют генетическую обусловленность.
Миастения поражает лиц как мужского, так и женского пола. Дебют заболевания может произойти в любом возрасте: от первых дней жизни до (миастения новорождённых) до пожилого возраста.
Заболеванием имеет прогрессирующий характер, быстро приводит к нарушению трудоспособности и социальной дезадаптации.
Рекомендовано применение блокаторов холинэстеразы.
Приложение Г. Приложение Г1. Врожденные миастенические синдромы
|
Расстройство |
Нейрофизиология |
Клиническая картина |
Генетика |
|
Пресинаптические |
|||
|
Врожденные миастенические синдромы с эпизодическим апноэ |
Декрементный ответ |
Эпизодическое апноэ или остановка дыхания в любое время после рождения, часто спровоцированное инфекцией. Офтальмоплегия встречается нечасто. Эффективны блокаторы холинэстеразы, состояние улучшается с возрастом. |
Мутация гена, кодирующего холин-ацетилтрансферазу |
|
Другие синдромы со снижением количества выброса ацетилхолина |
У одних больных напоминает миастенический синдром Ламберта-Итона, у других проявляется легкой атаксией или мозжечковым нистагмом. |
||
|
Синаптические |
|||
|
Недостаточность мембранной ацетилхолинэстеразы |
Повторяющийся и декрементный СПДМ при единичной стимуляции нерва |
Часто тяжелая с офтальмоплегией и слабостью, особенно осевых мышц. Медленная зрачковая реакция на свет. Применение блокаторов холинэстеразы неэффективно или вызывает ухудшение состояния. |
Мутация гена COLQ, кодирующего коллагеновый «хвост» ацетилхолинэстеразы |
|
Постсинаптические |
Недостаточность рецепторов, аномалии кинетики или нарушение группировки рецепторов. |
||
|
Недостаточность АХР |
Единичный ответ |
Тяжесть от легкой до тяжелой. Ранний дебют. Птоз, офтальмоплегия, орофарингеальные симптомы, слабость конечностей. Может улучшаться при лечении блокаторами АЦХЭ и 3,4-ДАП. Умеренная инвалидизация. |
Мутации генов субъединиц АХР |
|
Аномалии кинетики АХР |
|||
|
А. Синдром медленных каналов (СМК) |
Повторные CПДМ при одиночной стимуляции нерва |
Возраст дебюта и тяжесть вариабельны. Селективная слабость мышц шеи, лопатки и разгибателей пальцев. Легкая офтальмоплегия. Может ухудшаться при применении блокаторов АЦХЭ. Применяются хинидин и флуоксетин, но высок риск тяжелых побочных эффектов. |
Обычно аутосомно-доминантное. Описано аутосомно-рецессивное наследование. |
|
В. Синдром быстрых каналов(СБК) |
Вариабельный фенотип, от легкого до тяжелого. Эффективны блокаторы АЦХЭ моно или с 3,4-ДАП, но описана смерть двух детей после начала приёма, хотя причина смерти из-за 3,4-ДАП не доказана. |
Различные мутации генов субъединиц АХР |
|
|
Аномалии агрегации АХР: недостаточность мембранногорапсина |
|||
|
А. Рапсин-РД (ранний дебют) |
Часто нормальная ИСН |
Легкий артрогрипоз, гипотония, орофарингеальная дисфункция, эпизодические апноэ или остановка дыхания с рождения, у некоторых – лицевой дисморфизм, офтальмоплегия – редко. Эффективны блокаторы АХР моно или с 3,4-ДАП |
|
|
В. Рапсин ПД (поздний дебют) |
Дебют в подростковом или взрослом возрасте. Ошибочный диагноз серонегативной МГ. Эффективны блокаторы АЦХЭ. |
||
|
Другие |
|||
|
Мышечная рецепторная тирозинкиназа |
Декрементный ответ |
Дебют в неонатальном периоде. Птоз и респираторный дистресс. |
Мутации гена кодирующего мышце-специфическую рецепторнуютирозинкиназу (musk) |
|
SCN4A (Nav.1.4) натриевый канал |
Декрементный ответ |
Птоз, слабость, рецидивирующие дыхательные и бульбарные параличи |
Мутации гена, кодирующего вольтаж-зависимые натриевые каналы SCN4A (Nav.1.4) |
АХР-ацетилхолиновый рецептор; блокатор АХЭ – блокатор ацетилхолинэстеразы; СПДМ – суммарный потенциал действия мышцы; 3,4-ДАП – 3,4-диаминопиридин; ИСН – итерационная стимуляция нерва; МГ – миастения гравис.
Приложение Г2. Отличительные симптомы миастенического и холинергического кризов
|
Миастенический криз |
Холинергический криз |
|
М-холинергические (вегетативные) симптомы |
|
|
-сухость слизистых -густая слюна -мидриаз -тахикардия -повышение артериального давления |
-слезотечение, бронхорея, ринорея -жидкая слюна -миоз -брадикардия -понижение артериального давления -тошнота, рвота, кишечная колика, жидкий стул, полиурия |
|
Н-холинергические симптомы |
|
|
-положительная реакция на введение антихолинестеразных препаратов |
-ухудшение состояния на введение антихолинестеразных препаратов -фасцикулярные подергивания мышц -крампи, тремор мышц -эпилептиформные судороги |
Приложение Г3. Расшифровка примечаний.
…ж – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2016 год (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
…вк – лекарственный препарат, входящий в Перечень лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
Миастения — это наиболее частое аутоиммунное заболевание, характеризующееся поражением нервно-мышечных синапсов, вследствие выработки аутоантител к рецепторам ацетилхолина или к специфическим фермента – мышечноспецифической тирозин-киназы.
В результате этого развивается патологическая утомляемость и слабость скелетной мускулатуры, мутации в белках нервно-мышечных соединений могут приводить к развитию врожденных миастенических синдромов.
Что это такое?
Миастения – это довольно редко встречающееся заболевание аутоиммунного типа, характеризующееся слабостью и вялостью мышц. При миастении происходит нарушение связи между нервными и мышечными тканями.
Официальное научное название данного недуга звучит так – myasthenia gravis pseudoparalitica, что на русский язык переводится как астенический бульбарный паралич. В медицинской российской терминологии широко употребляют понятие “миастения Гравис”.
Причины миастении
На сегодняшний день специалисты не имеют четких сведений о том, что именно провоцирует возникновение у человека симптомов миастении. Миастения является аутоиммунным недугом, ведь в сыворотке больных обнаруживаются множественные аутоантитела. Врачи фиксируют определенное количество семейных случаев миастении, однако доказательств влияния наследственного фактора на проявление болезни нет.
Достаточно часто миастения проявляется параллельно с гиперплазией либо опухолью вилочковой железы. Также миастенический синдром может возникнуть у больных, которые жалуются на органические заболевания нервной системы, полидерматомиозит, онкозаболевания.
Чаще миастенией болеют представительницы женского пола. Как правило, проявляется болезнь у людей в возрасте 20– 30 лет. В целом заболевание диагностируется у пациентов в возрасте от 3 до 80 лет. В последние годы специалисты проявляют существенный интерес к данному заболеванию ввиду высокой частоты проявления миастении у детей и молодых людей, что приводит к последующей инвалидизации. Впервые данный недуг был описан более столетия тому назад.
Патогенез
В механизме развития миастении играют роль аутоиммунные процессы, обнаружены антитела в мышечной ткани и вилочковой железе. Часто поражаются мышцы век, появляется птоз, который варьирует по степени выраженности в течение дня; поражаются жевательные мышцы, нарушается глотание, изменяется походка. Больным вредно нервничать, так как это вызывает боль в груди и одышку.
Провоцирующим фактором может являться стресс, перенесённая ОРВИ, нарушение функции иммунной системы организма ведёт к образованию антител против собственных клеток организма — против ацетилхолиновых рецепторов постсинаптической мембраны нервно-мышечных соединений (синапсов). По наследству аутоиммунная миастения не передаётся.
Чаще всего заболевание проявляется во время переходного возраста у девочек(11-13 лет),реже встречается у мальчиков в этом же возрасте. Все чаще выявляется заболевание у детей дошкольного возраста (5-7 лет).
Классификация
Это заболевание у всех развивается по-разному. Чаще всего начинается миастения со слабости глазных и лицевых мышц, потом это нарушение переходит на мышцы шеи и туловища. Но у некоторых людей присутствуют только некоторые признаки заболевания. В соответствии с этим существует несколько видов миастении.
- Глазная форма характеризуется поражением черепно-мозговых нервов. Первым признаком этого является опущение верхнего века, чаще всего сначала с одной стороны. Больной жалуется на двоение в глазах, затруднения в движении глазными яблоками.
- Бульбарная форма миастении – это поражение жевательных и глотательных мышц. Кроме нарушения этих функций, у больного меняется речь, голос становится тихим, гнусавым, наблюдаются трудности в произношении некоторых звуков, например, «р» или «б».
- Но чаще всего встречается генерализованная форма заболевания, при которой сначала поражаются мышцы глаз, потом процесс распространяется на шею, верхние и нижние конечности. Особенно часто поражаются бедра и мышцы рук, больному сложно подниматься по лестнице, удерживать предметы. Опасность такой формы заболевания в том, что слабость распространяется на дыхательные мышцы.
Симптомы
К сожалению, чаще всего миастению диагностируют уже в тех случаях, когда заболевание протекает несколько лет подряд и переходит в запущенную форму. По этой причине любую необъяснимую усталость, вялость мышц, резко нарастающую при повторяющихся движениях слабость необходимо расценивать как возможный симптом миастении до тех пор, пока этот диагноз не будет полностью опровергнут.
К ранним симптомам относятся:
- нарушение глотания,
- затруднения при пережевывании твердой пищи вплоть до отказа от еды,
- при разговоре – «затухание голоса»,
- быстрая утомляемость при расчесывании, подъеме по лестнице, обычной ходьбе,
- появление шаркающей походки,
- опущение век.
Наиболее часто поражаются глазодвигательные, мимические, жевательные мышцы, а также мускулатура гортани и глотки. Следующие пробы помогают выявить скрыто протекающую миастению:
- Если пациента попросить быстро открывать и закрывать рот в течение 30 секунд, то здоровый человек сделает около 100 движений, а страдающий миастенией – меньше.
- Лечь на спину, приподнять голову и удерживать ее в таком положении 1 минуту, смотря при этом на свой живот.
- Вытянуть руки и постоять так 3 минуты.
- Сделать 15–20 глубоких приседаний.
- Быстро сжимать и разжимать кисти – у больного миастенией это зачастую вызывает опущение век.
Локальная форма миастении характеризуется проявлением мышечной слабости определенной группы мышц, а при генерализованной форме в процесс вовлекаются мышцы туловища или конечностей.
Миастенический криз
Как показывает клиническая практика, миастения является прогрессирующим заболеванием, а значит под воздействием тех или иных факторпараличов (внешней среды или причин эндогенного характера) степень и тяжесть симптомных проявлений болезни может нарастать. И даже у больных с легкой формой миастении может случиться миастенический криз.
Причиной этого состояния могут стать:
- травмы;
- стрессовые состояния:
- любые инфекции острого характера;
- прием медицинских препаратов с нейролептическим или транквилизирующим эффектом;
- хирургические вмешательства в организм и проч.
Симптоматика проявляется тем, что сначала появляется двоение в глазах. Затем больной ощущает внезапно нарастающий приступ мышечной слабости, двигательная активность мышц гортани снижается, что приводит к нарушению процессов:
- голосообразования;
- дыхания и глотания;
- усиливается слюноотделение и учащается пульс;
- могут расшириться зрачки, возникнуть тахикардия и наступить полный паралич без потери чувствительности.
Развитие острой недостаточности поступления кислорода в мозг могут привести к прямой угрозе жизни, поэтому в срочном порядке необходимо проведение реанимационных мероприятий.
Диагностика
Для того чтобы поставить правильный диагноз больному назначают комплексное исследование, так как клиническая картина миастении может быть схожей с другими заболеваниями. Основными методами диагностики выступают:
- Развернутые биохимические анализы крови на выявление антител;
- Электромиография – исследование, во время которого можно оценить потенциал мышечных волокон при их возбуждении;
- Генетический скрининг, который проводится для выявления врожденной формы миастении;
- Электронейрография – исследование, позволяющее оценить скорость передачи нервных импульсов к мышечным волокнам;
- МРТ – при помощи данного исследования можно заметить даже самые незначительные признаки гиперплазии вилочковой железы;
- Тест на мышечную утомляемость – пациента просят быстро открывать и закрывать несколько раз рот, махать руками и ногами, сжимать и разжимать кисти, приседать. Главным синдромом миастении является появление нарастающей мышечной слабости при повторении этих движений.
- Прозериновая проба – больному подкожно вводят прозерин, после чего ждут до получаса, а затем оценивают результат. Больной миастенией чувствует значительное улучшение своего состояния, а спустя несколько часов клинические симптомы возобновляются с прежней силой.
Как лечить миастению?
При тяжелом течении миастении показано удаление вилочковой железы в ходе оперативного вмешательства. К самым эффективным медикаментам, успешно применяемым для снятия симптомов заболевания, относят прозерин и калинин. Наряду с ними используют лекарственные средства, повышающие иммунитет, и ряд других медикаментов, улучшающих самочувствие пациента. Важно помнить, что чем раньше начато лечение, тем эффективнее оно будет.
На первой стадии заболевания в качестве симптоматической терапии применяют антихолинэстеразные препараты, цитостатики, глюкокортикоиды и иммуноглобулины. Если причиной миастении является опухоль, то проводится операция по её удалению. В тех случаях, когда симптомы миастении быстро прогрессируют, показана экстракорпоральная гемокоррекция, позволяющая очистить кровь от антител. Уже после первой процедуры больной отмечает улучшение состояния, для более стойкого эффекта лечение проводят несколько дней.
К новым, эффективным методам лечения относится криофорез – очищение крови от вредных веществ под воздействием низких температур. Процедура проводится курсом (5–7 дней). Преимущества криофореза перед плазмофорезом очевидны: в плазме, которая возвращается к пациенту после очистки, сохраняются все полезные вещества в неизменном виде, что помогает избежать аллергических реакций и вирусного заражения.
Также к новым методам гемокоррекции, применяемым в лечении миастении, относится каскадная плазменная фильтрация, при которой очищенная кровь, пройдя через нанофильтры, возвращается к пациенту. Уже после первых минут проведения процедуры больной отмечает улучшение самочувствия, полный курс лечения миастении требует пяти-семи дней.
К современным методам лечения миастении относится также и экстракорпоральная иммунофармакотерапия. В рамках проведения процедуры из крови больного выделяют лимфоциты, которые обрабатываются медикаментами и отправляются обратно в кровяное русло больного. Данная процедура при лечении миастении считается максимально эффективной. Она позволяет снизить активность иммунной системы, уменьшив продукцию лимфоцитов и антител. Подобная методика даёт стойкую ремиссию в течение года.
Профилактика миастении и её осложнений
Предотвратить заболевание нельзя, но можно сделать всё возможное для того, чтобы и с таким диагнозом жить полноценно.
- Во-первых, контроль врача. Таких пациентов ведут неврологи. Помимо прописанной схемы лечения и систематического посещения невролога необходимо контролировать общее состояние (сахар крови, давление и т. п.), чтобы не допустить развития других заболеваний на фоне лечения миастении.
- Во-вторых, стоит избегать чрезмерных нагрузок – физических и эмоциональных. Стрессы, тяжелая физическая работа, излишне активные виды спорта ухудшают состояние больных. Умеренная физзарядка, прогулки даже полезны.
- В-третьих, стоит исключить пребывание на солнце.
- В-четвертых, необходимо знать противопоказания для больных миастенией и строго их соблюдать.
- В-пятых, строго соблюдать прописанную врачом схему лечения, не пропускать прием препаратов и не принимать лекарства больше, чем назначено лечащим врачом.
Врач обязан выдать перечень медикаментов, противопоказанных такому пациенту. В него входят препараты магния, миорелаксанты, транквилизаторы, некоторые антибиотики, мочегонные препараты за исключением верошпирона, который, наоборот, показан.
Не стоит увлекаться иммуномодулирующими препаратами и любыми успокоительными, даже теми, которые кажутся безопасными (например, валерьянка или настойка пиона).
Прогноз
Ранее миастения была тяжёлым заболеванием с высокой летальностью — 30—40 %. Однако при современных методах диагностики и лечения летальность стала минимальной — менее 1 %, около 80 % на фоне правильного лечения достигают полного выздоровления или же ремиссии. Заболевание является хроническим, но требует тщательного наблюдения и лечения.
(
оценок, среднее:
из 5)
Миастенический синдром (астенический бульбарный паралич) характеризуется хроническим течением. Рецидивы патологического состояния сопровождаются выраженной слабостью мышц. У ряда пациентов миастенические расстройства быстро прогрессируют, что приводит к развитию параличей различных частей тела. Данный тип нарушений встречается редко. Для понимания сути миастении, что это такое, особенностей клинической картины, необходимо обратиться к причинам развития заболевания.
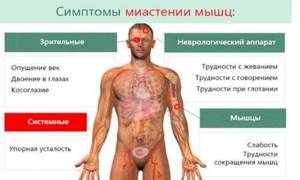
Миастенический синдром (астенический бульбарный паралич) характеризуется хроническим течением. Рецидивы патологического состояния сопровождаются выраженной слабостью мышц.
Что такое миастения, причины и основные симптомы
Миастения Гравис (определение используется в российской медицинской терминологии) — это нервно-мышечное заболевание аутоиммунного типа, проявляющееся при совершении обыденных действий: ведении разговора, потреблении пищи и так далее. То есть, причины возникновения симптомов расстройства обусловлены любой, даже незначительной нагрузкой, которую испытывает организм человека.
Миастенический криз возникает как следствие аномального поведения иммунной системы.
Организм атакует здоровые клетки, что провоцирует нарушение акта глотания, слабость дыхательных путей и иные расстройства.
Причины
Точные причины миастении пока не установлены. Считается, что заболевание может быть обусловлено генетической предрасположенностью. Но это предположение не получило официального подтверждения.
В зависимости от причинного фактора выделяют две формы патологии:
- врожденная;
- приобретенная.
Врожденный миастенический синдром развивается из-за мутации генов, вследствие чего синапсы нервно-мышечной системы функционируют аномально. Этот тип нарушений диагностируется редко.
Приобретенная форма легче поддается лечению. Чаще этот тип нарушений развивается на фоне опухолей или разрастания тканей (гиперплазия) вилочковой железы (центральный орган иммунной системы). Реже синдром возникает под воздействием следующих факторов:
- дерматомиозит;
- склеродермия;
- летаргический энцефалит;
- тиреотоксикоз;
- опухоли органов половой системы, легких, печени.
Последнее объясняет, почему миастения чаще диагностируется у женщин, чем у мужчин (примерное соотношение составляет 2:1). В группу риска развития синдрома входят люди в возрасте 20-40 лет.
Спровоцировать патологию могут также сильный стресс и ОРВИ.
Для понимания процессов, происходящих при миастеническом синдроме, следует обратиться к схематичному строению нервной системы. Каждый нейрон состоит из мембраны, внутрь которой проникают медиаторы, или специфические вещества. Медиаторы отвечают за передачу импульсов, которые генерируют клетки нервной системы. Мышечные ткани имеют рецепторы, связывающие медиатор ацетилхолин. Из-за нарушения данного процесса затрудняется передача импульсов от нервной системы к мышечной. А ответственность за то, что рецепторы перестают связывать ацетилхолин, несут клетки иммунитета.
Симптомы заболевания
Вне зависимости от формы миастении симптомы проявляются в виде:
- мышечная слабость;
- повышенная (чрезмерная) утомляемость.

Вне зависимости от формы миастении симптомы проявляются в виде мышечной слабости и повышенной утомляемости.
Изначально симптомы миастенического синдрома возникают редко. Мышечная слабость спадает после непродолжительного отдыха. Однако по мере прогрессирования заболевания интенсивность симптомов усиливается. Причем слабость наступает резко, а для восстановления организма требуется существенно больше времени.
Однако на начальном этапе развития расстройства интенсивность симптоматики меняется в течение суток. Поэтому нередко синдром классифицируют как один из признаков истерии, в связи с чем проводят неадекватное лечение. Дифференцировать миастению можно по отсутствию признаков, характерных для указанного неврологического расстройства:
- вегетативного нарушения;
- снижения чувствительности в проблемной зоне.
Еще одной важной особенностью миастенического синдрома является наличие симметричных симптомов.
В частности, мышечная усталость одновременно наблюдается, например, в правой и левой руке. Единственным исключением из этого правила считается опущение одного века, что происходит при поражении лицевой части головы.
При миастении никогда не возникают следующие симптомы (при условии отсутствия сопутствующих патологий):
- головные боли;
- онемение конечностей;
- головокружение;
- нарушение мочеиспускания;
- мышечные боли.

При миастении никогда не возникают головные боли.
Развитие миастении не затрагивает мышечные волокна, пролегающие в кистях рук и ступнях. То есть, двигательная активность конечностей сохраняется на прежнем уровне.
Миастения у детей
Миастения у детей носит часто врожденный характер. У матерей с этим типом расстройства в 10-20% случаев появляются дети с аналогичным нарушением. Причем заболевание у новорожденных имеет преходящий характер.
Первые признаки нервно-мышечных нарушений у ребенка возникают в течение 1-1,5 месяцев. Причиной развития патологии считается перенос антител к ацетилхолину через плаценту.
Формы и симптомы
Врожденная миастения бывает нескольких форм:
- Аутосомно-рецессивный синдром. Поражает большую часть мышц тела, что объясняется недостатком медиаторов ацетилхолин.
- Аутосомно-доминантный синдром. Наблюдается слабость мышц, расположенных в лопаточной области и на предплечьях. Волокна по мере развития синдрома атрофируются.
При аутосомно-доминантном синдроме также возможно снижение функциональности поясничных и бульбарных мышц. Интенсивность симптоматики в данном случае усиливается при физических нагрузках. Кроме того, при аутосомно-рецессивном синдроме характер клинической картины может меняться в зависимости от уровня концентрации ацетилхолина.
Миастенические расстройства у детей классифицируются на три типа в зависимости от особенностей нарушений:
- Генерализированные. Проявляются в виде нарушения дыхательной или сердечной деятельности. Возможно отсутствие указанных расстройств.
- Локальные. Область поражения затрагивает мышцы глотки и лицевой части головы с нарушением дыхательной функции или без этого. Также патологический процесс может локализоваться только в волокнах, ответственных за движение век.
- Скелетно-мышечные. Проявляются в виде дыхательных расстройств или без этого.
В первые несколько месяцев миастения у детей в основном затрагивает глазные мышцы, вследствие чего проявляются следующие симптомы:
- птоз;
- ограниченность движения глазных яблок;
- двоение перед глазами.
В первые несколько месяцев миастения у детей в основном затрагивает глазные мышцы.
Возможно появление и других симптомов, характерных для миастенического синдрома:
- дисфункция жевательных и мимических мышц;
- проблемы с глотанием;
- слабый крик;
- затрудненное дыхание.
Нередко развитие заболевания вызывает повышенную утомляемость мышечного аппарата, расположенного в области малого таза, шеи и рук. У детей в первый год жизни диагностируется безжизненное выражение лица и неподвижный взгляд. В дальнейшем отмечаются невнятная речь и носовое звучание голоса. Оба симптома возникают при продолжительном разговоре. Мышечная слабость у детей нарастает после физических нагрузок различной степени интенсивности.
В первое время у новорожденных отмечаются единичные симптомы. По мере прогрессирования миастении присоединяются другие признаки мышечных расстройств. В течение нескольких месяцев патологическое нарушение приобретает генерализированный характер, что чревато развитием тяжелых осложнений. При этом только у 12% пациентов диагностируются локальные формы заболевания.
При миастении у детей характер клинической картины не отличается от проявлений синдрома у взрослых. Разница в данном случае заключается в интенсивности симптоматики: у малышей заболевание протекает более остро.
Лечение
Лечение миастении у детей проводится с помощью антихолинэстеразных препаратов:
- «Прозерин» (вводится под кожу);
- «Калимин»;
- «Оксазил».
Лечение миастении у детей проводится с помощью антихолинэстеразных препаратов.
В случае если патология сопровождается затрудненным глотанием, назначается сочетание указанных препаратов. Например, за 30 минут до еды под кожу вводится «Прозерин», а по прошествии часа ребенку дают «Калимин», оказывающий более продолжительное воздействие.
Превышение допустимой дозировки назначенных препаратов вызывает холинергический криз, требующий незамедлительной госпитализации пациента. Данное состояние характеризуется медленным развитием. Холинергический криз провоцирует спазм в горле, покалывание в мышцах, побледнение кожи. Родители должны внимательно следить за изменениями, происходящими с ребенком после приема лекарств.
Если у детей диагностируется миастенический криз, то необходимо увеличить дозировку препаратов.
В тяжелых случаях назначаются кортикостероиды. Для улучшения передачи импульсов нервной системы к мышцам иногда применяется «Полифепан».
Лечение и прогноз развития заболевания зависят от наличия сопутствующих патологий. Проводя терапию миастении, важно исключить следующие лекарства, из-за которых состояние пациента ухудшается:
- хинин;
- клоназепам;
- магнийсодержащие препараты;
- антибиотики;
- карбонат лития;
- антидепрессанты тетрациклического ряда и другие.
В тяжелых случаях назначаются кортикостероиды. Для улучшения передачи импульсов нервной системы к мышцам иногда применяется «Полифепан». Кроме того, лечение патологии дополняется внутривенным введением иммуноглобулинов.
В отсутствии результатов медикаментозной терапии, а также при выраженных расстройствах, назначается хирургическое вмешательство.
Такое лечение предусматривает удаление вилочковой железы, дающее положительный эффект в 70-80% случаев. Причем максимальный результат удается добиться, если хирургическое вмешательство проводится у детей до 5 лет.
Формы миастении
При рассмотрении особенностей миастении, что это за болезнь, и характера клинической картины, следует выделить формы патологического расстройства. Выделяют следующие типы нарушений:
- глазная;
- бульбарная;
- генерализованная;
- миастенический синдром Ламберта-Итона;
- миастенический криз.
Такая классификация миастении позволяет подобрать наиболее эффективное лечение и исключить наличие других нарушений со сходной симптоматикой. Чаще у пациентов диагностируется генерализованная форма заболевания, которая проявляется сначала в виде нарушений глазодвигательных функций. В дальнейшем синдром затрагивает мышцы конечностей и тела.
Тяжелая миастения провоцирует развитие кризов, для которых характерна внезапная слабость. Чтобы предотвратить появление таких состояний, в практической неврологии применяется комплекс препаратов пролонгированного действия.
Бульбарная форма
Бульбарная миастения развивается при поражении одноименных нервов. Эта форма заболевания диагностируется в 15% случаев. Течение патологии вызывает снижение функциональности мышечного аппарата, составляющего лицо и горло.
Бульбарная форма миастении изначально проявляется как изменение тона голоса. Последний приобретает гнусавый характер и становится тише. Подобные изменения отмечаются к концу продолжительного разговора. Пациенты с бульбарной формой расстройства испытывают трудности с произношением шипящих звуков (дизартрия). В редких случаях отмечаются:
Развитие бульбарной формы сопровождается нарушением акта глотания. Пациенты, потребляя продукты, кашляют. При продолжительном пережевывании пищи может отвиснуть нижняя челюсть.
Также при бульбарной форме диагностируется слабость мимических мышц, что проявляется в неспособности:
- надуть щеки;
- улыбнуться обеими сторонами рта;
- оскалиться.
В пользу бульбарной формы говорит активное слюноотделение. Этот тип нарушений способен вызвать аспираторную пневмонию, развивающуюся на фоне попадания жидкости в дыхательные пути.
Глазная форма
Практически у всех пациентов с миастенией глазная форма заболевания проявляется как первый и основной симптом, свидетельствующий о наличии нервно-мышечного расстройства.
Этот тип нарушения проявляется в виде:
- птоза (опущение одного или обоих век);
- диплопии (двоение предметов).
Интенсивность симптоматики усиливается, когда пациент двигает глазами и сосредотачивается на изображении. Из-за птоза больной неспособен зажмуриться.
Глазная миастения характеризуется тем, что интенсивность симптоматики в течение суток меняется. Птоз проявляется сильнее к вечеру, а после ночного сна проблемное веко восстанавливает свою активность. Степень выраженности раздвоения зрения также меняется на протяжении дня.
Примерно у 50% пациентов глазная форма миастении не прогрессирует. У остальных больных патология продолжает развиваться, затрагивая другие группы мышц.
Миастенический синдром Ламберта-Итона
При миастеническом синдроме Ламберта-Итона нарушается проводимость нервных импульсов к мышцам шеи и конечностей. Из-за этого пациент не может долгое время держать голову прямо. Чаще миастенический синдром Ламберта-Итона диагностируется у пожилых людей. В этом случае пациенты передвигаются, опустив голову вперед.
При поражении мышечных волокон, пролегающих в конечностях, больные не способны долго ходить. Причем при высоких физических нагрузках проблемы возникают не только в работе ног или рук, но и других частей тела. Также возможно развитие птоза и нарушение процесса глотания.
При этой миастении лечение необходимо проводить в случае появления первых симптомов заболевания. Синдром Ламберта-Итона может быстро прогрессировать, что может стать причиной смертельного исхода.
Генерализованная миастения
Из всех типов миастении генерализованная форма провоцирует смерть пациента в 1% случаев. Причем данный показатель в последние годы продолжает уменьшаться. Раньше от этого заболевания стабильно погибали 35% пациентов.
По мере прогрессирования в патологический процесс вовлекаются остальные мышцы тела. Пациенты с этим типом нарушения испытывают трудности с удержанием головы в правильном положении.
Генерализованная миастения диагностируется чаще остальных расстройств данного типа. На начальном этапе развития заболевание затрагивает следующие мышцы:
- глазодвигательные;
- мимические;
- шейные.
По мере прогрессирования в патологический процесс вовлекаются остальные мышцы тела. Пациенты с этим типом нарушения испытывают трудности с удержанием головы в правильном положении. Одновременно возникают поперечная улыбка, глубокие морщины на лице и обильное слюноотделение.
Когда патологический процесс затрагивает конечности, то пациент испытывает серьезные трудности, совершая любые движения. Как и в случае с другими формами миастении, при генерализованной форме интенсивность симптоматики меняется в течение дня: утром состояние больного лучше, чем вечером.
Наиболее остро патология проявляется в бедренных и плечевых мышцах.
Последние при длительном развитии болезни со временем атрофируются. Также отмечается снижение сухожильных рефлексов, которые восстанавливаются после отдыха.
Опасность генерализованной формы миастении заключается в том, что болезнь затрагивает мышцы грудной клетки и диафрагмы. В отсутствии лечения патология вызывает дыхательную недостаточность.
Миастенический криз
Миастенический криз считается осложнением рассматриваемого расстройства. Это состояние характеризуется внезапной слабостью мышечного аппарата, ответственного за дыхание и процесс глотания. Миастенический криз проявляется в виде следующих симптомов:
- учащенное и свистящее дыхание;
- тахикардия;
- активное слюноотделение.
В случае возникновения миастенического криза пациенту требуется неотложная помощь. Это состояние вызывает паралич дыхательных мышц, что создает угрозу для жизни.
Миастения у большинства пациентов склонна к прогрессированию. Течение заболевания характеризуется резкой сменой рецидивов и ремиссий. Развитие миастенического синдрома может на время приостановиться, но встречается это редко.
Обострение патологии носит эпизодический либо длительный характер. В первом случае симптомы синдрома утихают быстро, после чего пациент не испытывает никаких проблем с работой мышечного аппарата. Длительная форма заболевания (миастеническое состояние) характеризуется появлением всех симптомов, свойственным данному типу нарушения. При этом не наблюдается усиление интенсивности клинических проявлений. Продолжительность миастенического состояния нередко составляет несколько лет.
Диагностика
Основу диагностики миастении составляет прозериновая проба. Этот метод предусматривает использование препарата «Прозерин», который блокирует расщепление ацетилхолина. В результате, прозериновый тест позволяет временно увеличить концентрацию медиатора.
Основу диагностики миастении составляет прозериновая проба. Этот метод предусматривает использование препарата «Прозерин», который блокирует расщепление ацетилхолина.
Метод проводится в два этапа. Вначале врач оценивает состояние мышечного аппарата. Затем вводится препарат, после чего спустя 30-40 минут повторяется первая процедура. В ходе обследования врач анализирует декремент (скорость утихания) сигнала к мышечным волокнам.
Аналогичная схема применяется в случаях, когда используется электромиография. Этот метод позволяет оценить электрическую активность мышечного аппарата. Электромиография применяется с целью исключения изолированного нарушения проводимости. То есть, метод дает возможность дифференцировать миастению с дисфункцией отдельного нерва или мышцы.
В отсутствии положительных результатов назначается электронейрография, позволяющая оценить проводящую способность нервов.
В ходе обследования пациента с миастенией также потребуется проведение анализа крови на наличие специфических антител, которые синтезирует иммунная система. Нередко диагноз ставится на основании результатов этого метода. Дополнительно назначается КТ средостения, посредством которой удается выявить наличие проблем в вилочковой железе.
При необходимости применяются другие методы обследования, с помощью которых миастения дифференцируется с патологиями мозга (опухоль, энцефалит и так далее) и нейро-мышечными заболеваниями (миопатия, БАС).
Методы лечения миастении
Лечение миастении направлено на восстановление концентрации ацетилхолина в организме. Для достижения этого результата назначаются лекарства, которые угнетают процессы, отвечающие за разрушение медиатора.
Чтобы определить, как лечить миастению, необходимо оценить характер развития патологии и степень вовлеченности различных групп мышц. Также при подборе схемы терапии важно учитывать возраст пациента и наличие сопутствующих заболеваний.
Прием антихолинэстеразных препаратов при миастении составляет основу лечения.
Прием антихолинэстеразных препаратов при миастении составляет основу лечения. Дозировку и тип лекарства определяет врач. Лечение необходимо проводить при непосредственном участии специалиста. Для полного восстановления организма потребуется несколько лет регулярного применения антихолинэстеразных препаратов.
Чтобы усилить действия этих лекарств, используются медикаменты, в состав которых входят соли кальция. Препараты также подбираются в зависимости от формы расстройства. При выраженной бульбарной миастении показано сочетание «Оксазила» и «Прозерина». В лечении синдрома Ламберта-Итона применяется пиридостигмина бромид. Аналогичный подход используется при глазной форме миастении.
Терапия заболевания предусматривает также прием:
- цитостатиков;
- антилимфоцитарного и антиимунного глобулина.
При болях в животе, дисфункции кишечника и фибриллярных подергиваниях мышц показан «Атропин» в виде раствора для инъекций или капель.
Для лечения пациента с генерализованной формой миастении необходимы кортикостероиды (в основном преднизолон), которые подавляют активность иммунной системы. Эти препараты имеют множественные противопоказания, поэтому дозировка и продолжительность терапии подбираются сугубо индивидуально. Одновременно с кортикостероидами необходимо вводить калия хлорид.
При болях в животе, дисфункции кишечника и фибриллярных подергиваниях мышц показан «Атропин» в виде раствора для инъекций или капель. Этот препарат применяется, если лечение спровоцировало холинергический криз (передозировка антихолинэстеразными лекарствами).
Важно при выраженной дисфункции дыхательных путей регулярно отсасывать слизь и бронхиальный секрет.
В случае активного прогрессирования миастенического синдрома, показано хирургическое удаление вилочковой железы. Если у пациентов диагностируется тимома, то за 2-3 года до операции данная часть иммунной системы подвергается рентгеновскому облучению.
Применение плазмофереза при миастении показано в тяжелых случаях. Подобные нарушения требуют проведение вентиляции легких и введение иммуноглобулинов, «Прозерина» и эфедрина.
Заниматься лечением миастении народными средствами крайне не рекомендуется. Эти лекарства не способны устранить патологию. Единственное, что может обеспечить лечение народными средствами — купировать некоторые симптомы миастенического синдрома, что достигается за счет коррекции питания.
Профилактические меры
Основу профилактики обострения синдрома составляет специальная диета. Питание при миастении предполагает включение в ежедневный рацион пациента продуктов, богатых калием:
- изюм;
- картофель;
- курага и другие сухофрукты;
- лук;
- овес;
- чеснок.
Питание при миастении предполагает включение в ежедневный рацион пациента продуктов, богатых калием.
Пациенты с миастенией должны регулярно проходить осмотр у невролога и контролировать состояние организма, поддерживая сахар и давление на должном уровне. Во избежание обострения синдрома важно исключить чрезмерные физические и эмоциональные нагрузки. Кроме того, пациентам следует избегать продолжительного нахождения под прямыми лучами солнца.
В случае развития других заболеваний, прежде чем приступать к их лечению, список используемых препаратов необходимо согласовать с врачом. Многие лекарства противопоказаны при рассматриваемом синдроме.
Миастения — это опасное заболевание, которое в отсутствии своевременного лечения вызывает смерть у 30-40% пациентов. Адекватная терапия позволяет добиться полного выздоровления или стойкой ремиссии в 80% случаев при условии соблюдения всех врачебных рекомендаций.
No related posts.
Оглавление Ключевые слова
- Патологическая утомляемость,
- Слабость лицевой мускулатуры,
- Офтальмологические нарушения,
- Бульбарные расстройства,
- Нарушение витальных функций,
- Антихолинэстеразные препараты.
Список сокращений
АХ – ацетилхолин
ГКС — глюкокортикостероиды
Термины и определения
Новые и узконаправленные профессиональные термины в настоящих клинических рекомендациях не используются
1. Краткая информация
1.1 Определение
Миастения – это аутоиммунное заболевание, характеризующееся нарушением нервно-мышечной передачи и проявляющееся слабостью и патологической утомляемостью скелетных (поперечнополосатых) мышц.
1.2 Этиология и патогенез
По современным представлениям, основой патогенеза миастении является аутоиммунная реакция, вызванная связыванием антителами ацетилхолиновых рецепторов (АХР) постсинаптических мембран поперечно-полосатой мускулатуры. Число этих рецепторов значительно снижено под воздействием этих аутоантител. В некоторых случаях при аутоиммунной миастении гравис (МГ) не выявляются антитела (АТ) к АХР, и такая форма получила название серонегативной миастении гравис (СН-МГ). Термин «серонегативная» является неточным по отношению к группе пациентов, включая детей, имеющих АТ класса IgG к мышечной специфической рецепторной тирозинкиназе (МуСК). Эта форма получила название МуСК-МГ. Хотя получены убедительные доказательства патогенности АХР АТ, патогенетическая роль МуСК АТ остается неясной. Могут выявляться и другие АТ, роль которых не установлена, в том числе к титину, рианодиновым рецепторам и внутриклеточному АХР-связанному протеину рапсину.
Механизм, запускающий выработку АТ, остается неизвестным. На роль вилочковой железы указывает сочетание АХР и лимфоидной гиперплазиии опухолей тимуса, а также эффективность тимэктомии. При МуСК-МГ если и выявляются, то лишь небольшие гистологические изменения тимуса. На наличие генетической предрасположенности указывает относительно часто наблюдающиеся клинические и электромиографические (ЭМГ) симптомы у родственников больного и часто встречающиеся отдельные группы антигенов главного комплекса тканевой совместимости человека (HLA).
Отмечается сочетание с другими аутоиммунными расстройствами, особенно с патологией щитовидной железы (гипер- или гипотиреоз), ревматоидным артритом, красной волчанкой и диабетом. По данным некоторых исследователей злокачественные опухоли отмечались у 5% детей.
1.3 Эпидемиология
Миастения — заболевание относительно редкое, хотя существует достаточно оснований считать, что наблюдают его значительно чаще, чем считали ранее. Наиболее предрасположены к заболеванию лица с фенотипом HLA-B3, HLA-B8, HLA-DW3. Распространенность миастении составляет 0,5 – 5 случаев на 100 тыс. населения, однако в настоящее время имеется тенденция к увеличению числа больных и составляет 10 – 24 случая на 100 тыс. населения. Миастения может дебютировать в любом возрасте, начиная с раннего детства (чаще у девочек и в подростковом возрасте) и заканчивая глубокой старостью. Дети и подростки до 17 лет составляют 9-15% больных миастенией. В детском возрасте чаще встречается ювенильная форма миастении. Приблизительно у 5-20% младенцев (по данным разных источников), рожденных больными миастенией матерями, развивается транзиторная неонатальная миастения (ТНМ), обусловленная переносом через плацентарный барьер антител к ацетилхолиновым рецепторам (АХР) от матери. Наиболее высокая заболеваемость отмечается в 2-х возрастных категориях: 20-40 лет (в этот период чаще болеют женщины) и 65-75 лет (в этот период мужчины и женщины поражаются одинаково часто). Средний возраст начала болезни у женщин — 26 лет, у мужчин — 31 год.
1.4 Кодирование по МКБ-10
G70 – Myasthenia gravis и другие нарушения нервно-мышечного синапса: исключены: ботулизм (A05.1), транзиторная неонатальная Myasthenia gravis (P94.0)
G70.0 – Myasthenia gravis
G70.1 — Токсические нарушения нервно-мышечного синапса
G70.2 — Врожденная или приобретенная миастения
G70.8 — Другие нарушения нервно-мышечного синапса
G70.9 — Нарушение нервно-мышечного синапса неуточненное
1.5 Примеры диагнозов
- Миастения, генерализованная форма, прогрессирующее течение, средняя степень тяжести, достаточная компенсация на фоне АХЭП.
- Миастения, локальная (глазная) форма, стационарное течение, легкая степень тяжести, хорошая компенсация на АХЭП.
- Миастения, генерализованная форма с дыхательными нарушениями, прогрессирующее тяжелое течение с недостаточной компенсацией на АХЭП.
1.6 Классификация
Существует несколько классификаций миастении. Наиболее распространена в мире классификация по Оссерману (принята как международная в 1959г. в Лос-Анжелесе, модифицирована в 1971г. Оссерманом и Дженкиным).
Генерализованная миастения:
- Миастения новорожденных
- Врожденная миастения
- Доброкачественная с офтальмопарезом или офтальмоплегией
- Семейная детская
- Юношеская миастения
Глазная миастения:
- Юношеская
- Взрослая
В.С. Лобзиным в 1960г. предложена классификация миастении по течению патологического процесса:
1 – острое начало с быстрым развитием симптомокомплекса и в дальнейшем медленное прогрессирование,
2 – острое начало, более длительное (от 3 месяцев до 1 года) развитие синдрома, течение с ремиссиями, но неуклонным прогрессирование,
3 – постепенное начало, медленное развитие на протяжении нескольких лет и последующее медленно прогрессирующее течение,
4 – начало с ограниченной группы мышц и медленное прогрессирование.
В 1965 г. А.Г. Пановым, Л.В. Довгелем и В.С. Лобзиным разработана классификация миастении по локализации патологического процесса с учетом нарушения витальных функций (нарушением дыхания и сердечной деятельности):
1 — генерализованная:
а) без нарушения витальных функций, б) с нарушением дыхания и сердечной деятельности;
2 — локальная:
а) лицевая форма (глазная, глоточно-лицевая), б) скелетно-мышечная форма: без нарушения дыхания и с нарушением дыхания.
Наиболее удобна для практического врача классификация, предложенная в 1965 г. Б.М. Гехтом. В ней учитывается характер течения заболевания, степень генерализации миастенического процесса, тяжесть двигательных расстройств и степень их компенсации на фоне ингибиторов ацетилхолинэстеразы (АХЭ), что помогает достаточно полно и точно сформулировать диагноз.
По характеру течения:
1. Миастенические эпизоды (однократный или ремиттирующее течение) – преходящие двигательные нарушения с полным регрессом (10-12%).
2. Миастенические состояния (т.е. стационарное течение) – стационарная непрогрессирующая форма в течение многих лет (13%).
3. Прогрессирующее течение – неуклонное прогрессирование заболевания (50-48%).
4. Злокачественная форма – острое начало и быстрое нарастание нарушения функции мышц (25%).
Формы переходят друг в друга.
По локализации:
– локальные (ограниченные) процессы: глазные, бульбарные, лицевые, краниальные, туловищные;
– генерализованные процессы: генерализованные без бульбарных нарушений, генерализованные и генерализованные с нарушением дыхания.
По степени тяжести двигательных расстройств:
— легкая
— средней тяжести
— тяжелая
По степени компенсации двигательных нарушений на фоне ингибиторов ацетилхолинэстеразы (АХЭ):
— полная,
— достаточная,
— недостаточная (плохая).
2. Диагностика
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб обращают внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных или полных ремиссий, обратимость симптомов на фоне приема ингибиторов АХЭ (на время их действия) и на фоне адекватной иммуносупрессивной терапии.
2.2 Физикальное обследование
Клинический осмотр должен включать исследование общего неврологического статуса, а также проверку силы произвольных мышц лица, шеи, туловища и конечностей до и после нагрузки (оценка силы в баллах, где 0 – отсутствие силы, 5 – сила данной группы мышц здорового человека). Одним из самых важных клинических тестов для диагностики миастении является наличие синдрома патологической мышечной утомляемости: нарастание симптомов после нагрузки. Например, нарастание птоза, глазодвигательных нарушений при фиксации взора, после зажмуривания; снижение силы в отдельных группах мышц после повторных активных движений в исследуемой конечности, приседаний или ходьбы; появление или нарастание речевых нарушений при счете, чтении вслух и т.д. При этом не выявляется никаких симптомов органического поражения нервной и нервно-мышечной системы (при отсутствии сопутствующих заболеваний): нет нарушений в рефлекторной и координаторной сфере, сохранена чувствительность, в типичных случаях отсутствуют мышечные атрофии, сохранен мышечный тонус.
Ювенильная аутоиммунная миастения гравис (ЮМГ)
Симптомы болезни могут развиваться в любом возрасте старше одного года, но наиболее часто проявляются у девочек в подростковом возрасте. Начало болезни может быть постепенным или внезапным.
Клиническая картина характеризуется:
- поражением глазодвигательных мышц с диплопией, офтальмоплегией и птозом (могут быть симметричными, асимметричными или односторонними),
- слабость мышц лица (особенно круговой мышцы глаза),
- слабость проксимальных отделов конечностей,
- поражение дыхательной и ротоглоточной мускулатуры,
- глубокие сухожильные рефлексы сохранены.
При обследовании детей с развившейся дыхательной недостаточностью при отсутствии легочной патологии необходимо учитывать возможность ЮМГ, даже если отсутствуют другие симптомы этого заболевания.
Первоначально мышечная сила может быть нормальной или почти нормальной, и поэтому мышечную силу нужно оценивать до и после физической нагрузки.
Частота случаев, при которых поражение ограничено только глазодвигательными мышцами (глазная миастения), существенно отличается в различных публикациях, но, вероятно, составляет 20-50%, и до 80% у маленьких детей в Китае. МуСК-МГ чаще встречается у женщин, в клинической картине преобладает слабость глазодвигательных мышц и мышц черепа, отмечаются частые респираторные кризы. Различия между МуСК-МГ и АХР-МГ еще предстоит выяснить.
Транзиторная неонатальная форма (миастения новорожденных)
Клинические проявления включают:
- общую мышечную гипотонию,
- слабый крик,
- затрудненное дыхание и сосание,
- возможно развитие птоза,
- амимии, глазодвигательных нарушений,
- расстройств глотания, снижение глубоких рефлексов.
Врожденные миастенические синдромы более подробно представлены в приложении Г1.
Преходящий миастенический синдром, проявляющийся у таких детей в первые дни жизни и продолжающийся в течение 1-1,5 мес., обусловлен переносом через плацентарный барьер антител к АХР от матери.
- сопутствующими заболеваниями, и являются отличительным признаком состояния, называемого сейчас ВМС с эпизодическим апноэ).
Таким образом, отличием всех симптомов миастении является динамичность в течение суток, усиление после нагрузки, обратимость или уменьшение степени их выраженности после отдыха.
Миастенический криз, при котором по разным причинам происходит резкое ухудшение состояния с нарушением витальных функций. Молекулярной основой миастенического криза, вероятно, является резкое уменьшение количества функционирующих АХР вследствие массированной атаки их аутоантителами. Часто миастенический криз провоцируется бронхолегочной инфекцией, а в ряде случаев на фоне криза развивается пневмония, и тогда нарушения дыхания могут носить смешанный характер.
Дифференцировать миастенический криз от других тяжелых состояний, сопровождающихся респираторными расстройствами, можно по наличию:
- бульбарного синдрома,
- гипомимии,
- птоза,
- асимметричного наружного офтальмопареза,
- слабости и утомляемости мышц конечностей и шеи (уменьшающихся в ответ на введение ингибиторов АХЭ).
Следует отличать миастенический криз от холинергического (Приложение Г2), который развивается при избыточной дозе ингибиторов АХЭ. Общими симптомами кризов является выраженная слабость произвольной мускулатуры с нарушением дыхания и бульбарным синдромом, психомоторное возбуждение и нарушение сознания (сопор, кома).
Смешанные (миастенический + холинергический) кризы встречаются у больных миастенией при неправильном приеме и / или изначально узком диапазоне терапевтических доз ингибиторов АХЭ, а также на фоне состояний, вызывающих общую или мышечную слабость различного генеза (интеркуррентные инфекции, соматические, гормональные нарушения, прием препаратов, влияющих на сократительную функцию произвольных мышц и др.).
2.3 Лабораторная диагностика
(Сила рекомендаций – 1; достоверность доказательств – С)
- Рекомендуется определение антихолинэстеразных антител.
Комментарии: Антитела к АХР выявляются у детей в пределах 60-80%. В препубертатном возрасте тест положителен примерно у 50% детей. Титр антител снижается у успешно пролеченных пациентов. Из серонегативных на антитела к АХР, около 40-50% серонегативны на антитела к МуСК. Более высокая частота наличия этих антител у детей точно не установлена, но они могут присутствовать при начале заболевания в раннем детском возрасте.
2.4 Инструментальная диагностика
- Рекомендуется проведение итерационной стимуляции нерва (ИСН), что позволяет выявить электрическую нервно-мышечную блокаду.
(Сила рекомендаций – 1; достоверность доказательств – С)
Комментарии: Этот тест вызывает стресс, особенно у маленьких детей, и поэтому должен выполняться щадяще. Технические трудности у маленьких детей также составляют проблему, и поэтому перед тем, как объявлять тест положительным, нужно быть полностью уверенным, что снижение амплитуды происходит по миастеническому типу. Суммарные потенциалы действия мышцы фиксируются с поверхностных электродов, лучше над слабой мышцей; частота стимуляции нерва 3Гц и 5Гц. Снижение амплитуды более чем на 10% в промежутке с третьего по пятый потенциал считается положительным результатом. Одноволоконная ЭМГ, позволяющая выявить усиленное «дрожание» при сокращении пар волокон, является более чувствительным, чем классическая ИСН, но трудновыполнимым у детей методом. Нормальная ИСН не исключает диагноза ЮМГ.
- Рекомендуется в диагностически сложных случаях проводится морфологическое исследование мышечного биоптата (световая, электронная микроскопия, гистохимическое, иммуногистохимическое, иммунофлуоресцентное и другие виды визуального изучения нервно-мышечного соединения и окружающих его тканей).
Комментарии: Основные качественные и количественные изменения при миастении обнаруживаются в постсинаптической мембране, которая содержит АХР, и в стадии развернутой клинической картины число АХР снижается до 10-30% от нормальных значений, падает их плотность.
2.5 Иная диагностика
(Сила рекомендаций – 1; достоверность доказательств – С)
- Рекомендуется применение антихолинэстеразных препаратов — проба с ингибиторами АХЭ: неостигминаметилсульфат (код АТХ: N07AA01), пиридостигмина гидрохлорид (код АТХ: N07AA02). После введения одного из этих препаратов эффект наблюдается в одной или нескольких ослабленных мышцах. Наиболее часто проводится проба с неостигминаметилсульфатом. Доза подбирается индивидуально из расчета 0,125 мг/кг массы тела (ориентировочно: 1,5мл 0,05% раствора – при массе тела до 70кг и 2мл – при массе тела более 70кг или при выраженной генерализованной слабости мышц конечностей без учета массы тела). Можно избрать любой парентеральный путь введения препарата, но обычно делается подкожная инъекция. Оценивается действие препарата через 30-40 минут.
Комментарии: Положительной полной проба считается при восстановлении мышечной силы до 5 баллов с компенсацией бульбарных и глазодвигательных нарушений, положительной неполной – при нарастании силы на 1-2 балла, но без полного ее восстановления и (или) сохранении редуцированного бульбарного или глазодвигательного дефекта. Частичная компенсация заключается в избирательном действии ингибиторов АХЭ на отдельные группы мышц, как правило, с нарастанием силы произвольных мышц на 1балл. Выделяется сомнительная прозериновая проба, когда отмечается некоторая положительная динамика в отношении отдельных симптомов (уменьшение птоза на 1-2мм, некоторое увеличение объема движений глазных яблок, несколько более звонкий голос, впечатление о некотором нарастании силы мышц конечностей и т.д.
- Рекомендуется введение внутримышечное или подкожное неостигмина метилсульфата при подозрении на транзиторную неонатальную форму (миастения новорожденных).
Комментарии: Клинические симптомы позволяют поставить правильный диагноз, если известно о существовании миастении у матери, но заболевание матери может быть недиагностированным или протекать бессимптомно. Диагноз подтверждается при внутримышечном или подкожном введении Неостигмина метилсульфата (Код АТХ: N07AA01); ИСН также может выполняться для подтверждения диагноза, но ее проведение в этом возрасте технически затруднительно и болезненно. Для диагностики, а затем и для лечения, предпочтительнее применять Неостигмина метилсульфат (код АТХ: N07AA01, Прозерин), особенно перед кормлением, так как его эффект продолжается дольше, что дает больше времени для обследования (например, разовая доза 0,1 мг перед кормлением, а дополнительные дозы — по мере необходимости).
Если диагноз миастении вызывает сомнения, требуется динамическое наблюдение, проведение пробного курса ингибиторов АХЭ ( пиридостигмина гидрохлорид в сочетании с препаратами калия – только строго избегая холинергических реакций), повторное клиническое и электромиографическое (ЭМГ) обследование.
Антихолинэстеразный тест и ИСН не обладают высокой чувствительностью и специфичностью, тогда как наличие антител к АХР специфично для миастении гравис.
2.6 Дифференциальная диагностика.
Диагноз миастения ставится на основании совокупности клинических данных, результатов инструментальных обследований. Главное отличие миастении от других форм патологии — динамичность симптомов и положительная реакция на введение антихолинэстеразных препаратов.
Необходимо исключение следующих заболеваний:
— эндокринная офтальмопатия;
— окулофарингеальная мышечная дистрофия;
— рассеянный склероз;
— синдром Фишера;
— ботулизм;
— синдром Толосы-Ханта;
— митохондриальные цитопатии;
— конгенитальные миастенические синдромы и др.
Бульбарные проявления миастении следует дифференцировать с сосудистыми и опухолевыми поражениями мозга, для которых типичны выраженные общемозговые симптомы, а также отсутствие динамичности нарушений и реакции на введение антихолинэстеразных препаратов.
Иногда значительные трудности возникают при дифференциальной диагностике миастении и бокового амиотрофического склероза (БАС), при котором в некоторых случаях возможны не только клинические симптомы миастении, но и нарушения нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. В таких случаях правильный диагноз можно поставить только после проведения ЭМГ, выявляющей признаки денервации и реиннервации, а также наличие большого количества потенциалов фасцикуляций, характерных для БАС. Дыхательные расстройства и кризы при миастении следует дифференцировать с синдромом Гийена-Барре (СГБ), для которого характерна арефлексия, нарушение состава ликвора, отсутствие нарушений нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов.
Слабость мышц туловища и конечностей у больных миастенией дифференцируют с различными формами врождённых и приобретённых миопатий.
Миопатический процесс, как правило, характеризуется отличным от миастении характером распределения двигательных расстройств: отсутствием (за редким исключением) признаков поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; чаще сопровождается снижением или отсутствием сухожильных рефлексов, различной степенью выраженности мышечных атрофий.
Клинические симптомы, напоминающие миастению, возможны и при других формах нарушения нервно-мышечной передачи, таких, как синдром Ламберта-Итона и ботулизм. И если для синдрома Ламберта-Итона не типичны экстраокулярные, бульбарные и дыхательные нарушения, то именно они составляют основное клиническое ядро ботулизма. Характерные для синдрома Ламберта-Итона слабость и утомляемость мышц туловища и конечностей при ботулизме выявляют относительно редко. Для обеих форм характерна гипо- или арефлексия.
Эффект от введения антихолинэстеразных препаратов при синдроме Ламберта-Итона минимальный, а при ботулизме отсутствует. Нарушения нервно-мышечной передачи характеризуются снижением исходной амплитуды М-ответа и её существенным увеличением в процессе высокочастотной стимуляции (инкремент) или после максимального произвольного усилия.
3. Лечение
3.1 Консервативное лечение
- Рекомендовано применение блокаторов холинэстеразы.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Эти препараты увеличивают период полураспада выброшенного в синаптическую щель ацетилхолина (АХ) путем ингибирования его гидролиза ацетилхолинэстеразой, увеличивая таким образом вероятность того, что молекулы АХ достигнут рецепторов, число которых снижено.
- Пиридостигмина бромидж, вк (код ATX:N07AA02) в дозе до 7 мг/кг/день назначается в 3-5 приемов.
- Неостигмина метилсульфатж, вк (код АТХ:N07AA01) начальная доза составляет 0,2-0,5 мг/кг каждые четыре часа у детей до 5 лет и 0,25 мг/кг у более старших детей, максимальная разовая доза 15 мг.
- Рекомендовано применение кортикостероидов.
(Сила рекомендаций – 2; достоверность доказательств – В)
Комментарии: ГКС вызывают ремиссию у большинства детей с ЮМГ. Преднизолон ж ,вк (код АТХ: Н02АВ06) назначается в дозе 1-2 мг/кг/день до достижения устойчивого эффекта, после чего препарат постепенноотменяют.
- Рекомендовано применение других видов длительной иммунотерапии.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии:
- Азатиоприн ж ,вк (код АТХ:L04АХ01) можно применять в комбинации со стероидами или отдельно. Начальная доза 50 мг/сутки и до 100–200 мг/сутки вместе с поддерживающей дозой Преднизолона.
- Циклоспоринж (код АТХ: L04AD01) можно назначать при непереносимости Азатиоприн.
- Циклофосфамид ж, вк (Код АТХ: L01AA01) применяется при очень тяжелом течение болезни.
- Пульс-терапия высокими дозами Метилпреднизолона ж ,вк (H02AB04) применяется у детей с рефрактерным течением болезни.
- Рекомендовано применение замещения плазмы.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Плазмаферез применяется для лечения миастенических кризов, а также для пре- и после операционной поддержки. Проводится внутривенное введение иммуноглобулинов класса G – иммуноглобулин человека нормальный ж ,вк (код АТХ: J06BA02, Иммуноглобулин человека нормальный) Эффект наблюдается через 3-4 дня и сохраняется до 3-х месяцев.
3.2 Хирургическое лечение
- Рекомендовано применение тимэктомии.
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: применяется в качестве основного метода длительного лечения, особенно у детей с высоким риском развития осложнений лечения блокаторами ХЭ или кортикостероидами, либо других видов иммунотерапии.
Показаниями к оперативному лечению являются:
а) злокачественные формы;
б) прогрессирующая форма;
в) миастеническое состояние в зависимости от степени выраженности дефекта.
При локальных формах к оперативному лечению подходят избирательно.
Противопоказания к тимэктомии:
- тяжелые декомпенсированные соматические заболевания;
До оперативного лечения обязательна предоперационная подготовка:
- общеукрепляющая терапия;
- проведение лечебного плазмафереза;
- при необходимости — курс глюкокортикостероидной терапии.
4. Реабилитация
Не требуется
5. Профилактика и диспансерное наблюдение
5.1 Профилактика
Профилактика не разработана.
5.2 Ведение пациентов
Ведение пациентов с миастенией в амбулаторно-поликлинических условиях должно включать:
- ЭКГ всем детям 1 раз в 3 месяц.
- ?УЗИ брюшной полости, сердца, почек – 1 раз в 6 месяц.
- ?рентгенологическое обследование грудной клетки, суставов, при необходимости позвоночника, крестцово-подвздошных сочленений — 1 раз в 6 месяц.
- ?эзофагогастродуоденоскопия с биопсией на Helicobacter pylori и морфологической диагностикой — 1 раз в 6 месяцев для исключения эрозивных, язвенных процессов и гастропатий.
- ?при обострении — УЗИ внутренних органов и рентгенография органов грудной клетки, ЭКГ и другие необходимые инструментальные методы обследования (КТ, МРТ) по показаниям:
- пациентам с миастенией реакция Манту проводится, обследование на туберкулез осуществляется под контролем фтизиатра
- при выявлении положительных туберкулиновых проб (папула > 5 мм) направление на консультацию к врачу – фтизиатру для решения вопроса о проведения Диаскин-теста или туберкулиновых проб с разведением и проведении специфической терапии
Ведение пациента, получающего иммуносупрессивную терапию
- осмотр врача-невролога – 1 раз в месяц;
- ?клинический анализ крови (концентрация гемоглобина, число эритроцитов, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) — 1 раз в 2 недели;
- ?при снижении числа лейкоцитов, эритроцитов, тромбоцитов ниже нормы — иммунодепрессанты отменить на 5–7 дней. После контрольного анализа крови при нормализации показателей — возобновить прием препарата;
- ?анализ биохимических показателей (общий белок, белковые фракции, концентрация мочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) — 1 раз в 2 неделю:
- при повышении уровня мочевины, креатинина, трансаминаз, билирубина выше нормы — иммунодепрессанты отменить на 5–7 дней. Возобновить прием препарата после восстановления биохимических показателей;
- ?анализ иммунологических показателей (концентрация Ig A, M, G; СРБ, РФ, АНФ) —1 раз в 3 месяца.
Ведение пациента с миастенией, получающего антихолинэстеразные препараты
- ?осмотр врача невролога 1 раз в месяц;
- ? клинический анализ крови (концентрация гемоглобина, число эритроцитов, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) — 1 раз в 2 недели;
- ?анализ биохимических показателей (общий белок, белковые фракции, концентрация мочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) — 1 раз в 2 недели;
- ? анализ иммунологических показателей (концентрация Ig A, M, G; СРБ, РФ, АНФ) —1 раз в 3 месяца;
- плановая госпитализация 2 раза в год для проведения полного обследования и при необходимости коррекции терапии.
Пациентам с миастенией показано оформление статуса «ребенок – инвалид». В периоды обострения болезни необходимо обеспечение обучения на дому. В стадии ремиссии болезни рекомендуются занятия ЛФК со специалистом, знакомым с особенностями патологии. При посещении школы? занятия физкультурой в общей группе не показаны. Больным миастенией противопоказаны профилактические прививки, введение ? глобулина.
Пациенты с диагнозом миастения должны находиться под постоянным диспансерным наблюдением педиатра и невролога. Детям с данной патологией показано комплексное обследование в условиях специализированного круглосуточного/дневного стационара, средняя продолжительность госпитализации – 21 день. Целесообразно проведение курсов реабилитационной терапии сроком не менее 21-28 дней 2-3 раза в год под наблюдением невропатолога, врача-физиотерапевта и специалиста ЛФК.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Исходы и прогноз
Наиболее тяжелое течение миастении наблюдается у детей с множественными стигмами дисэмбриогенеза (костно-мышечные дисплазии, аномалии развития центральной нервной системы), нейроэндокринными нарушениями (диэнцефально-височные пароксизмальные состояния, задержка роста и полового созревания на фоне гипопитуитарного синдрома, приобретенный гирсутизм и другие), незрелостью лимфоидной системы носоглотки (аденоиды, тонзиллит, фарингит), бронхообструктивным синдромом и другой сопутствующей патологией. У мальчиков с дебютом заболевания в препубертатный период и регрессом симптомов миастении к концу пубертата, как правило, отмечаются стойкие ремиссии.
Выбор правильной тактики лечения позволяет достигнуть положительного эффекта (стойкая полная или частичная ремиссия на фоне приема медикаментозных средств или без них) у 80 % больных миастенией. Однако, до настоящего времени не существует методов прогноза течения заболевания и специфических патогенетических методов лечения миастении.
Критерии оценки качества медицинской помощи
Таблица 1 — Организационно-технические условия оказания медицинской помощи.
|
Вид медицинской помощи |
Специализированная медицинская помощь |
|
Условия оказания медицинской помощи |
Стационарно / в дневном стационаре |
|
Форма оказания медицинской помощи |
Плановая |
Таблица 2 — Критерии качества оказания медицинской помощи
|
№ |
Критерий |
Уровень достоверности доказательств |
Сила рекомендации |
|
|
Выполнено определение антихолинэстеразных антител, проба с ингибиторами АХЭ |
С |
|
|
|
Выполнено проведение итерационной стимуляции нерва |
С |
|
|
|
Выполнено применение блокаторов холинэстеразы (при отсутствии медицинских противопоказаний) |
В |
|
|
|
Проведена иммуносупрессивная терапиия глюкокортикостероидами (при отсутствии медицинских противопоказаний) |
В |
Список литературы
- Аутоиммунные болезни нервно-мышечной передачи. В кн.: Краткий справочник невролога. – М.: «АБВ-пресс», 2015. – С. 129-139.
- Гузева В.И., Чухловина М.Л. Клинические рекомендации по диагностике и лечению миастении у детей. В книге: Детская неврология. Выпуск 1: клинические рекомендации/ под ред. В.И. Гузевой. – М.: ООО «МК», 2014. – С. 101-127.
- Санадзе А.Г. Миастения. В кн.: Аутоиммунные заболевания в неврологии. Под. ред. Завалишина И.А., Пирадова М.А., Бойко А.Н., Никитина С.С., Спирина Н.Н., Переседовой А.В. Клиническое руководство. – Т.2. – М.: РООИ «Здоровье человека», 2014. – С. 101-128.
- Айкарди Ж. Заболевания нервной системы у детей. — Т.2. – М.: Бином, 2013. – С. 940-949.
- Санадзе А.Г. Миастения и миастенические синдромы. М.: Литтерра, 2012. – 256 с.
- Супонева Н.А., Пирадов М.А. Миастения гравис. В кн.: Внутривенная иммунотерапия в неврологии. М: Горячая линия-Телеком, 2013. – С. 165-191.
- Kaminski H.J. Myasthenia gravis. In book: Neuromuscular disorders in clinical practice (Eds. Katirji B., Kaminski H.J., Ruff R.L.). – New York: Springer, 2014. – P. 1075-1088.
- Parr J., Jayawant S., Buckley C., Vincent A. Childhood autoimmune myasthenia. In book: Inflammatory and autoimmune disorders of the nervous system in children (Eds. Dale R.C., Vincent A.). London: Mac Keith Press, 2010. – P. 388-405.
Приложение А1. Состав рабочей группы
Баранов А.А., акад. РАН, профессор, д.м.н., Председатель Исполкома Союза педиатров России.
Намазова-Баранова Л.С., акад. РАН, профессор, д.м.н., заместитель Председателя Исполкома Союза педиатров России.
Куренков А.Л., профессор, д.м.н., член Союза педиатров России
Кузенкова Л.М., профессор, д.м.н., член Союза педиатров России
Гольцова Н.В., к.м.н., член Союза педиатров России
Мамедъяров А.М., к.м.н., член Союза педиатров России
Бурсагова Б.И., к.м.н., член Союза педиатров России
Вишнева Е.А., к.м.н., член Союза педиатров России
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-педиатры, врачи-неврологи;
- Врачи-ортопеды;
- Врачи-ЛФК, врачи-физиотерапевты,
- Врачи общей практики (семейные врачи);
- Студенты медицинских ВУЗов;
- Обучающиеся в ординатуре и интернатуре.
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска — 5 лет.
Методы, использованные для оценки качества и силы доказательств:
- консенсус экспертов;
- оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
- обзоры опубликованных мета-анализов;
- систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Рекомендуемая доброкачественная практика базируется на клиническом опыте авторов разработанных рекомендаций.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций
- Внешняя экспертная оценка.
- Внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций.
От врачей первичного звена получены комментарии в отношении доходчивости изложения данных рекомендаций, а также их оценка важности предлагаемых рекомендаций, как инструмента повседневной практики.
Все комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы (авторами рекомендаций). Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован независимыми экспертами, которых, прежде всего, попросили прокомментировать доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Основные рекомендации
Сила рекомендаций (1-2) на основании соответствующих уровней доказательств (А-С).
Таблица П1 — Схема для оценки уровня рекомендаций
|
Степень достоверности рекомендаций |
Соотношение риска и преимуществ |
Методологическое качество имеющихся доказательств |
Пояснения по применению рекомендаций |
|
1А Сильная рекомендация, основанная на доказательствах высокого качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот |
Надежные непротиворечивые доказательства, основанные на хорошо выполненных РКИ или неопровержимые доказательства, представленные в какой-либо другой форме. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Сильная рекомендация, которая может использоваться в большинстве случаев у преимущественного количества пациентов без каких-либо изменений и исключений |
|
1В Сильная рекомендация, основанная на доказательствах умеренного качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот |
Доказательства, основанные на результатах РКИ, выполненных с некоторыми ограничениями (противоречивые результаты, методологические ошибки, косвенные или случайные и т.п.), либо других веских основаниях. Дальнейшие исследования (если они проводятся), вероятно, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. |
Сильная рекомендация, применение которой возможно в большинстве случаев |
|
1С Сильная рекомендация, основанная на доказательствах низкого качества |
Польза, вероятно, будет превалировать над возможными рисками и затратами, либо наоборот |
Доказательства, основанные на обсервационных исследованиях, бессистемном клиническом опыте, результатах РКИ, выполненных с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. |
Относительно сильная рекомендация, которая может быть изменена при получении доказательств более высокого качества |
|
2А Слабая рекомендация, основанная на доказательствах высокого качества |
Польза сопоставима с возможными рисками и затратами |
Надежные доказательства, основанные на хорошо выполненных РКИ или подтвержденные другими неопровержимыми данными. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Слабая рекомендация. Выбор наилучшей тактики будет зависеть от клинической ситуации (обстоятельств), пациента или социальных предпочтений. |
|
2В Слабая рекомендация, основанная на доказательствах умеренного качества |
Польза сопоставима с рисками и осложнениями, однако в этой оценке есть неопределенность. |
Доказательства, основанные на результатах РКИ, выполненных с существенными ограничениями (противоречивые результаты, методологические дефекты, косвенные или случайные), или сильные доказательства, представленные в какой-либо другой форме. Дальнейшие исследования (если они проводятся), скорее всего, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. |
Слабая рекомендация. Альтернативная тактика в определенных ситуациях может явиться для некоторых пациентов лучшим выбором. |
|
2С Слабая рекомендация, основанная на доказательствах низкого качества |
Неоднозначность в оценке соотношения пользы, рисков и осложнений; польза может быть сопоставима с возможными рисками и осложнениями. |
Доказательства, основанные на обсервационных исследованиях, бессистемного клинического опыта или РКИ с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. |
Очень слабая рекомендация; альтернативные подходы могут быть использованы в равной степени. |
*В таблице цифровое значение соответствует силе рекомендаций, буквенное — соответствует уровню доказательности
Актуализация данных клинических рекомендаций будет проводиться не реже, чем один раз в три года. Принятие решения об обновлении будет принято на основании предложений, представленных медицинскими профессиональными некоммерческими организациями с учётом результатов комплексной оценки лекарственных препаратов, медицинских изделий, а также результатов клинической апробации.
Приложение А3. Связанные документы
Порядки оказания медицинской помощи: Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи»
Стандарты оказания медицинской помощи: Приказ Министерства здравоохранения РФ от 24.12.2012 N 1538н «Об утверждении стандарта специализированной медицинской помощи при тяжелой миастении, осложненной кризом» (Зарегистрировано в Минюсте России 13 марта 2013 N 27646)
Приложение Б. Алгоритмы ведения пациента
|
Пациент с подозрением на миастению |
|
Консультация профильного специалиста |
|
Диагноз подтвержден по Подтвержден? |
НЕТ
|
Лечение блокаторами АХЭ в стационаре |
ДА
|
Диспансерное наблюдение и АХЭ терапия |
ДА
НЕТ
|
Показана коррекция АХЭ терапии |
Приложение В. Информация для пациентов
Миастения – тяжелое аутоиммунное нервно-мышечное заболевание с прогрессирующим течением, клинически проявляющееся патологической мышечной утомляемостью, приводящей к парезам и параличам. Иммунологические нарушения при миастении имеют генетическую обусловленность.
Миастения поражает лиц как мужского, так и женского пола. Дебют заболевания может произойти в любом возрасте: от первых дней жизни до (миастения новорождённых) до пожилого возраста.
Заболеванием имеет прогрессирующий характер, быстро приводит к нарушению трудоспособности и социальной дезадаптации.
Рекомендовано применение блокаторов холинэстеразы.
Приложение Г. Приложение Г1. Врожденные миастенические синдромы
|
Расстройство |
Нейрофизиология |
Клиническая картина |
Генетика |
|
Пресинаптические |
|||
|
Врожденные миастенические синдромы с эпизодическим апноэ |
Декрементный ответ |
Эпизодическое апноэ или остановка дыхания в любое время после рождения, часто спровоцированное инфекцией. Офтальмоплегия встречается нечасто. Эффективны блокаторы холинэстеразы, состояние улучшается с возрастом. |
Мутация гена, кодирующего холин-ацетилтрансферазу |
|
Другие синдромы со снижением количества выброса ацетилхолина |
У одних больных напоминает миастенический синдром Ламберта-Итона, у других проявляется легкой атаксией или мозжечковым нистагмом. |
||
|
Синаптические |
|||
|
Недостаточность мембранной ацетилхолинэстеразы |
Повторяющийся и декрементный СПДМ при единичной стимуляции нерва |
Часто тяжелая с офтальмоплегией и слабостью, особенно осевых мышц. Медленная зрачковая реакция на свет. Применение блокаторов холинэстеразы неэффективно или вызывает ухудшение состояния. |
Мутация гена COLQ, кодирующего коллагеновый «хвост» ацетилхолинэстеразы |
|
Постсинаптические |
Недостаточность рецепторов, аномалии кинетики или нарушение группировки рецепторов. |
||
|
Недостаточность АХР |
Единичный ответ |
Тяжесть от легкой до тяжелой. Ранний дебют. Птоз, офтальмоплегия, орофарингеальные симптомы, слабость конечностей. Может улучшаться при лечении блокаторами АЦХЭ и 3,4-ДАП. Умеренная инвалидизация. |
Мутации генов субъединиц АХР |
|
Аномалии кинетики АХР |
|||
|
А. Синдром медленных каналов (СМК) |
Повторные CПДМ при одиночной стимуляции нерва |
Возраст дебюта и тяжесть вариабельны. Селективная слабость мышц шеи, лопатки и разгибателей пальцев. Легкая офтальмоплегия. Может ухудшаться при применении блокаторов АЦХЭ. Применяются хинидин и флуоксетин, но высок риск тяжелых побочных эффектов. |
Обычно аутосомно-доминантное. Описано аутосомно-рецессивное наследование. |
|
В. Синдром быстрых каналов(СБК) |
Вариабельный фенотип, от легкого до тяжелого. Эффективны блокаторы АЦХЭ моно или с 3,4-ДАП, но описана смерть двух детей после начала приёма, хотя причина смерти из-за 3,4-ДАП не доказана. |
Различные мутации генов субъединиц АХР |
|
|
Аномалии агрегации АХР: недостаточность мембранногорапсина |
|||
|
А. Рапсин-РД (ранний дебют) |
Часто нормальная ИСН |
Легкий артрогрипоз, гипотония, орофарингеальная дисфункция, эпизодические апноэ или остановка дыхания с рождения, у некоторых – лицевой дисморфизм, офтальмоплегия – редко. Эффективны блокаторы АХР моно или с 3,4-ДАП |
|
|
В. Рапсин ПД (поздний дебют) |
Дебют в подростковом или взрослом возрасте. Ошибочный диагноз серонегативной МГ. Эффективны блокаторы АЦХЭ. |
||
|
Другие |
|||
|
Мышечная рецепторная тирозинкиназа |
Декрементный ответ |
Дебют в неонатальном периоде. Птоз и респираторный дистресс. |
Мутации гена кодирующего мышце-специфическую рецепторнуютирозинкиназу (musk) |
|
SCN4A (Nav.1.4) натриевый канал |
Декрементный ответ |
Птоз, слабость, рецидивирующие дыхательные и бульбарные параличи |
Мутации гена, кодирующего вольтаж-зависимые натриевые каналы SCN4A (Nav.1.4) |
АХР-ацетилхолиновый рецептор; блокатор АХЭ – блокатор ацетилхолинэстеразы; СПДМ – суммарный потенциал действия мышцы; 3,4-ДАП – 3,4-диаминопиридин; ИСН – итерационная стимуляция нерва; МГ – миастения гравис.
Приложение Г2. Отличительные симптомы миастенического и холинергического кризов
|
Миастенический криз |
Холинергический криз |
|
М-холинергические (вегетативные) симптомы |
|
|
-сухость слизистых -густая слюна -мидриаз -тахикардия -повышение артериального давления |
-слезотечение, бронхорея, ринорея -жидкая слюна -миоз -брадикардия -понижение артериального давления -тошнота, рвота, кишечная колика, жидкий стул, полиурия |
|
Н-холинергические симптомы |
|
|
-положительная реакция на введение антихолинестеразных препаратов |
-ухудшение состояния на введение антихолинестеразных препаратов -фасцикулярные подергивания мышц -крампи, тремор мышц -эпилептиформные судороги |
Приложение Г3. Расшифровка примечаний.
…ж – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2016 год (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
…вк – лекарственный препарат, входящий в Перечень лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
Миастения у детей
Содержание
Что такое Миастения у детей —
Миастения относится к аутоиммунным заболеваниям, с преходящей мышечной слабостью и патологической утомляемостью. Иммунологические нарушения при миастении имеют генетическую обусловленность.
Оглавление:
- Миастения у детей
- Содержание
- Что такое Миастения у детей —
- Что провоцирует / Причины Миастении у детей
- Патогенез (что происходит?) во время Миастении у детей
- Симптомы Миастении у детей
- Диагностика Миастении у детей
- Лечение Миастении у детей
- Профилактика Миастении у детей
- Миастения у детей
- Что такое Миастения у детей —
- Что провоцирует / Причины Миастении у детей:
- Патогенез (что происходит?) во время Миастении у детей:
- Симптомы Миастении у детей:
- Диагностика Миастении у детей:
- Лечение Миастении у детей:
- Профилактика Миастении у детей:
- К каким докторам следует обращаться если у Вас Миастения у детей:
- Миастения у детей
- Миастения у детей
- Оглавление
- Ключевые слова
- Список сокращений
- Термины и определения
- 1. Краткая информация
- 1.1 Определение
- 1.2 Этиология и патогенез
- 1.3 Эпидемиология
- 1.4 Кодирование по МКБ-10
- 1.5 Примеры диагнозов
- 1.6 Классификация
- 2. Диагностика
- 2.1 Жалобы и анамнез
- 2.2 Физикальное обследование
- 2.3 Лабораторная диагностика
- 2.4 Инструментальная диагностика
- 2.5 Иная диагностика
- 2.6 Дифференциальная диагностика.
- 3. Лечение
- 3.1 Консервативное лечение
- 3.2 Хирургическое лечение
- 4. Реабилитация
- 5. Профилактика и диспансерное наблюдение
- 5.1 Профилактика
- 5.2 Ведение пациентов
- 6. Дополнительная информация, влияющая на течение и исход заболевания
- 6.1 Исходы и прогноз
- Критерии оценки качества медицинской помощи
Распространенность миастении составляет 1-5 случаев на 100 тыс. населения, имеется тенденция к увеличению числа больных. Дети и подростки до 17 лет составляют 9-15% больных миастенией, чаще болеют девочки. Средний возраст к началу болезни – 7,2 года. Клинические наблюдения показывают, что миастения может начаться в любом возрасте.
Что провоцирует / Причины Миастении у детей
Основой происхождения миастении является аутоиммунная реакция на ацетилхолиновые рецепторы (АХР) скелетных мышц. Антитела к ацетилхолиновым рецепторам являются причиной нервно-мышечного блока.
Проявлением иммунопатологических реакций у больных миастенией считают изменения в тимусе, или вилочковой железе, (центральный орган иммунной системы). Это отмечается у большинства больных, у которых заболевание развилось в возрасте от 1 года до 17 лет. Иммунологические методы исследования позволяют определить у больных миастенией изменения структур постсинаптической мембраны.
Патогенез (что происходит?) во время Миастении у детей
У детей, рожденных от матерей с миастенией, в 10-20% случаев диагностируют миастению новорожденных, при которой миастенический синдром имеет преходящий характер. Клинические проявления включают общую мышечную гипотонию, слабый крик, затрудненное дыхание и сосание, возможно развитие птоза (опущения какого-либо органа), амимии, глазодвигательных нарушений, расстройств глотания, снижение глубоких рефлексов. Доказано, что преходящий миастенический синдром, проявляющийся у таких детей в первые дни жизни и продолжающийся в течение 1-1,5 мес., обусловлен переносом через плацентарный барьер антител к АХР от матери.
Различают 6 форм врожденной миастении с разными типами наследования, которые следует рассматривать как врожденные миастенические синдромы. Среди них выделяют:
- аутосомно-рецессивный синдром с генерализованной мышечной утомляемостью, обусловленной дефицитом ацетилхолинэстеразы концевых пластинок;
- аутосомно-доминантный синдром со слабостью и атрофией лопаточных мышц и мышц предплечья;
- аутосомно-рецессивный синдром, при котором размер синаптических пузырьков, содержащие АХР ниже нормы;
- аутосомно-рецессивный синдром, вызванный снижением количества АХР на концевой пластинке;
- аутосомно-рецессивный синдром, проявляющийся генерализованной патологической утомляемостью мышц, обусловленной сниженным содержанием синаптических пузырьков и уменьшением освобождения ацетилхолина;
- аутосомно-доминантный синдром со слабостью бульбарных и поясничных мышц, усиливающейся при мышечном напряжении и контактом с теплом.
Следует подчеркнуть, что врожденные миастенические синдромы возникают обычно у детей, матери которых не страдают миастенией, миастенические симптомы определяются при рождении.
Выделяют следующие типы расстройств миастении:
- генерализованную двух видов:
- без нарушения дыхания и сердечной деятельности;
- с нарушением дыхания и сердечной деятельности.
- локальную:
- глоточно-лицевую: без нарушения дыхания; с нарушением дыхания;
- глазную;
- скелетно-мышечную:
- без нарушения дыхания;
- с нарушением дыхания.
Симптомы Миастении у детей
В детском возрасте чаще встречается ювенильная форма миастении. Первыми симптомами могут быть глазодвигательные нарушения: птоз, ограничение объема движений глазных яблок, двоение. Последний симптом иногда трудно выявить, так как маленькие дети не могут часто объяснить свои ощущения. Отмечаются нарушения жевательных мышц, мимической мускулатуры, расстройства глотания, дисфония, дизартрия. Часто появляется патологическая утомляемость в мышцах тазового пояса, шеи, верхних конечностей. Лицо больного ребенка может иметь безжизненное выражение лица, часто верхние веки опущены, взор неподвижный. Отмечаются усиление птоза, невнятность речи, появление носового оттенка голоса – в конце продолжительного разговора; наблюдается утомляемость при повторных активных движениях. Мышечная слабость и утомляемость обычно нарастают к вечеру.
Нарастание мышечной слабости отмечается после физических усилий. Так, появляется птоз при повторном приседании, сжатии рук в кулак, при повторных горизонтальных движениях глазных яблок.
У детей миастения чаще начинается моносимптомно, но очень быстро присоединяются другие симптомы; характерна генерализация процесса в течение первых месяцев. Течение обычно прогрессирующее, у большинства детей выявляются генерализованные формы с тяжелыми проявлениями. Локальные формы миастении у детей встречаются в 12% случаев, течение их более тяжелое, чем у взрослых.
При глоточно-лицевой и скелетно-мышечной форме быстро развиваются нарушения дыхания и сердечной деятельности.
При генерализованной форме миастении в патологический процесс вовлекаются, прежде всего, мышцы краниального отдела, шеи, конечностей, туловища. Утомляемость и слабость мышц усиливаются после физической нагрузки, к концу дня. Двигательные расстройства обусловливаются преимущественным поражением мышц отделов рук, ног, слабостью мышц шеи.
При глазной форме в клинической картине доминируют глазодвигательные расстройства: птоз, односторонний или двухсторонний, двоение, косоглазие; выраженность симптомов бывает непостоянной, усиливаясь к вечеру, уменьшаясь после отдыха, отмечается своеобразный «нистагм» за счет слабости и утомления наружных мышц глаза.
При глоточно-лицевой форме миастении слабость мимических мышц сочетается со слабостью мышц гортани, мягкого неба и языка, возможно возникновение неподвижности языка, неба. Это проявляется нарушением речи (фонации и артикуляции), глотания.
Диагностика Миастении у детей
Диагностика миастении у детей представляет значительную трудность в связи с вариабельностью клинических симптомов и особенностями обследования ребенка.
Задача клинического обследования – выявить главный признак заболевания – патологическую утомляемость мышц. Для подтверждения диагноза используются прозериновая проба, электромиография, сцинтиграфия вилочковой железы, исследование иммунного статуса.
Прозериновая проба с оценкой силы и утомляемости пораженных мышц проводится до и спустя 30 мин после внутримышечного введения 0,05% раствора прозерина в разовой возрастной дозе. Различают:
- резко положительную прозериновую пробу, когда исчезают все миастенические симптомы;
- положительную пробу – остаются только отдельные симптомы;
- слабоположительную пробу, при которой уменьшается выраженность миастенических симптомов;
- сомнительную прозериновую пробу – степень выраженности проявлений миастении изменяется незначительно;
- отрицательную прозериновую пробу – клиническая симптоматика не изменяется после введения прозерина.
О постановке диагноза миастении можно судить, имея один из первых трех вариантов прозериновой пробы.
Электрофизиологические исследования при миастении проводятся с целью определения феномена «миастенической реакции» – прогрессирующего снижения силы мышечного сокращения при стимуляции нерва. В настоящее время у детей используют глобальную электромиографию, при которой после физической нагрузки отмечается значительное снижение амплитуды, уменьшение времени электроактивности, снижение частоты токов действия. Для уточнения характера патологии тимуса исследуют не только функциональную активность тимуса, но и проводят томографию переднего средостения, пневмомедиа-стинографию, компьютерную томографию грудной клетки. Известно, что у 8-9% больных миастенией диагностируют опухоль тимуса – тимому, характеризующуюся быстрым развитием с преимущественным поражением мышц, осуществляющих акт глотания, мимических мышц.
Наряду с оценкой иммунного статуса, делают серологический анализ на определение антител к АХР, количество которых у большинства больных повышено. При локализованных формах миастении эти показатели и электрофизиологические данные могут быть не изменены, поэтому дифференциальная диагностика локализованных форм миастении достаточно сложна. Дифференциальная диагностика необходима для исключения заболеваний, в структуре которых имеет место миастенический синдром. К ним относятся ботулизм, отравление антибиотиками из группы аминогликозидов, болезнь Иценко-Кушинга, болезнь Аддисона, гипо- и гипертиреоз, полимиозит.
Лечение Миастении у детей
В лечение миастении используют консервативные и оперативные методы.
Основу консервативной терапии составляют антихолинэстеразные препараты (АХЭП). Используют прозерин (неостигмин), калимин (пиридостигмина бромид), оксазил. Доза АХЭП подбирается индивидуально и зависит от возраста ребенка, формы заболевания, результатов прозериновой пробы, позволяющей оценить реакцию на препарат, достигнутую степень компенсации, наличие или отсутствие побочных эффектов. При выборе АХЭП учитывается свойственная им фармакокинетика:
Прозерин при подкожном введении в дозе 1-2 мл 0,05% раствора действует уже черезмин, максимальный эффект проявляется спустямин после инъекции. Продолжительность действия – 2-3 ч.
Калимин при приеме внутрь вызывает эффект черезмин, который продолжается до 5-6 ч.
Оксазил начинает действовать черезмин в течение 6-8 ч.
При нарушении глотания часто применяют сочетание АХЭП: за 30 мин до еды внутримышечно вводят 1 мл 0,05% раствора прозерина, а через 1 ч после него назначают внутрь калимин, дающий более продолжительный эффект.
В случаях выраженной передозировки АХЭП может развиться холинергический криз, который проявляется симптомами сочетанной мускариновой и никотиновой интоксикации. Возникают брадикардия, миоз, фибриллярные подергивания, повышенная саливация, схваткообразная боль в животе, рвота, понос, возбуждение, нарушение дыхания (бронхоспазм, гиперкапния). В тяжелых случаях развивается тремор, судороги и наступает смерть. В младшем возрасте (до 1 года) организм более вынослив к антихолинэстеразным средствам. Поэтому родителям необходимо быть очень внимательными и следить за проявляением побочных эффектов у ребенка. В случае холинергического криза необходима немедленная госпитализация больного ребенка. Холинергический криз развивается медленно, в течение нескольких дней, для него характерно покалывание в мышцах, ощущение спазма в горле, признаки периферической сосудистой недостаточности: бледные кожные покровы, холодные конечности, мраморность кожи.
Также у больных может наблюдаться миастенический криз, при котором утяжеление состояния больного обусловлено недостаточной дозой АХЭП. В лечении миастенического криза используют прозерин или калимин в более высоких дозах.
Некоторые лекарственные препараты утяжеляют течение миастении: антибиотики (неомицин, стрептомицин, те-трациклины), d-пеницилламин, гидантоин, магнийсодержащие препараты, хинин, хинидин, клоназепам, а также миорелаксанты, полимиксин, канамицин, гентамицин, линкомицин, клиндамицин, фенитоин, карбонат лития, трициклические антидепрессанты, новопассит.
При тяжелой форме миастении назначают кортикостероидные препараты: преднизолон 1,5 мг/кг в сутки и более, ориентируясь на клиническое состояние больного.
Заслуживает внимания метод энтеросорбции, в частности с использованием полифепана. Данный метод приводит к улучшению нервно-мышечной передачи. Имеются данные об успешном применении у детей с миастенией плазмафереза как компонента комплексной терапии.
При миастении могут быть использованы иммуноглобулины для внутривенного введения (интраглобин, иммуноглобулин, пентаглобин). Их вводят в доземг/кг в сутки в течение 2-5 дней. Индивидуальная непереносимость иммуноглобулинов может проявляться головной болью, тошнотой, головокружением, рвотой, диареей, тахикардией, цианозом, одышкой, гипертермией, ознобом, повышенным потоотделением, болью в спине, миалгией и др. Перечисленные симптомы могут проявляться через 30 мин после начала инфузии и наблюдаться в течение первых суток.
Оперативное лечение миастении в детском возрасте заключается в тимэктомии (удаление вилочковой железы), которая при миастении дает положительный эффект в 70-80% случаев. Основные показания к тимэктомии:
- наличие тимомы или кисты тимуса;
- недостаточная эффективность лечения с помощью АХЭП;
- резистентность к проводимой терапии, несмотря на высокие дозы АХЭП;
- непереносимость АХЭП.
У детей оперативное лечение показано при тяжелых и средней тяжести формах заболевания. Лучшие результаты наблюдают у больных с наименьшей продолжительностью заболевания. Дети, которые были больны миастенией менее 5 лет, имеют улучшение после операции в 98% случаев, больше 5 лет – только в 71%.
После операции тимэктомии больных переводят в диспансер. Лечение продолжается сниженной дозой препаратов АХЭП, дополнительно назначают витамины группы В, витамин Е, АТФ. Длительное наблюдение за детьми с миастенией, перенесшими операцию тимэктомию, показывает, что отличные и хорошие результаты (полное выздоровление, значительное улучшение) наблюдаются у 75-80% больных.
Кортикостероиды (преднизолон и др.) назначают:
- в дооперационном периоде – при тяжелой форме миастении;
- в послеоперационном периоде – при отсутствии эффекта тимэктомии или при ухудшении состояния в ближайшем или отдаленном периоде. Существуют различные схемы кортикостероидной терапии, которые разрабатываются и назначаются индивидуально, в зависимости от тяжести протекания болезни.
В настоящее время, несмотря на достигнутые успехи в терапии, продолжается совершенствование методов лечения миастении у детей.
Профилактика Миастении у детей
Если ребенку поставлен диагноз миастения, ему запрещены чрезмерные физические нагрузки и долгое нахождение на солнце. Питание ребенка должно содержать малокалорийные продукты. В целях профилактики необходимо принимать препараты, укрепляющие иммунитет. Во время лечения и профилактики при миастении есть ряд препаратов, которые не показаны к применению, к ним относятся: нейролептики, мочегонные, транквилизаторы, антибиотики групп фторохинолонов. Поэтому при выборе лекарственного средства стоит быть осторожными.
Миастения у детей
Что такое Миастения у детей —
Миастения относится к аутоиммунным заболеваниям, с преходящей мышечной слабостью и патологической утомляемостью. Иммунологические нарушения при миастении имеют генетическую обусловленность.
Распространенность миастении составляет 1-5 случаев на 100 тыс. населения, имеется тенденция к увеличению числа больных. Дети и подростки до 17 лет составляют 9-15% больных миастенией, чаще болеют девочки. Средний возраст к началу болезни – 7,2 года. Клинические наблюдения показывают, что миастения может начаться в любом возрасте.
Что провоцирует / Причины Миастении у детей:
Основой происхождения миастении является аутоиммунная реакция на ацетилхолиновые рецепторы (АХР) скелетных мышц. Антитела к ацетилхолиновым рецепторам являются причиной нервно-мышечного блока.
Проявлением иммунопатологических реакций у больных миастенией считают изменения в тимусе, или вилочковой железе, (центральный орган иммунной системы). Это отмечается у большинства больных, у которых заболевание развилось в возрасте от 1 года до 17 лет. Иммунологические методы исследования позволяют определить у больных миастенией изменения структур постсинаптической мембраны.
Патогенез (что происходит?) во время Миастении у детей:
У детей, рожденных от матерей с миастенией, в 10-20% случаев диагностируют миастению новорожденных, при которой миастенический синдром имеет преходящий характер. Клинические проявления включают общую мышечную гипотонию, слабый крик, затрудненное дыхание и сосание, возможно развитие птоза (опущения какого-либо органа), амимии, глазодвигательных нарушений, расстройств глотания, снижение глубоких рефлексов. Доказано, что преходящий миастенический синдром, проявляющийся у таких детей в первые дни жизни и продолжающийся в течение 1-1,5 мес., обусловлен переносом через плацентарный барьер антител к АХР от матери.
Различают 6 форм врожденной миастении с разными типами наследования, которые следует рассматривать как врожденные миастенические синдромы. Среди них выделяют:
- аутосомно-рецессивный синдром с генерализованной мышечной утомляемостью, обусловленной дефицитом ацетилхолинэстеразы концевых пластинок;
- аутосомно-доминантный синдром со слабостью и атрофией лопаточных мышц и мышц предплечья;
- аутосомно-рецессивный синдром, при котором размер синаптических пузырьков, содержащие АХР ниже нормы;
- аутосомно-рецессивный синдром, вызванный снижением количества АХР на концевой пластинке;
- аутосомно-рецессивный синдром, проявляющийся генерализованной патологической утомляемостью мышц, обусловленной сниженным содержанием синаптических пузырьков и уменьшением освобождения ацетилхолина;
- аутосомно-доминантный синдром со слабостью бульбарных и поясничных мышц, усиливающейся при мышечном напряжении и контактом с теплом.
Следует подчеркнуть, что врожденные миастенические синдромы возникают обычно у детей, матери которых не страдают миастенией, миастенические симптомы определяются при рождении.
Выделяют следующие типы расстройств миастении:
- генерализованную двух видов:
- без нарушения дыхания и сердечной деятельности;
- с нарушением дыхания и сердечной деятельности.
- локальную:
- глоточно-лицевую: без нарушения дыхания; с нарушением дыхания;
- глазную;
- скелетно-мышечную:
- без нарушения дыхания;
- с нарушением дыхания.
Симптомы Миастении у детей:
В детском возрасте чаще встречается ювенильная форма миастении. Первыми симптомами могут быть глазодвигательные нарушения: птоз, ограничение объема движений глазных яблок, двоение. Последний симптом иногда трудно выявить, так как маленькие дети не могут часто объяснить свои ощущения. Отмечаются нарушения жевательных мышц, мимической мускулатуры, расстройства глотания, дисфония, дизартрия. Часто появляется патологическая утомляемость в мышцах тазового пояса, шеи, верхних конечностей. Лицо больного ребенка может иметь безжизненное выражение лица, часто верхние веки опущены, взор неподвижный. Отмечаются усиление птоза, невнятность речи, появление носового оттенка голоса – в конце продолжительного разговора; наблюдается утомляемость при повторных активных движениях. Мышечная слабость и утомляемость обычно нарастают к вечеру.
Нарастание мышечной слабости отмечается после физических усилий. Так, появляется птоз при повторном приседании, сжатии рук в кулак, при повторных горизонтальных движениях глазных яблок.
У детей миастения чаще начинается моносимптомно, но очень быстро присоединяются другие симптомы; характерна генерализация процесса в течение первых месяцев. Течение обычно прогрессирующее, у большинства детей выявляются генерализованные формы с тяжелыми проявлениями. Локальные формы миастении у детей встречаются в 12% случаев, течение их более тяжелое, чем у взрослых.
При глоточно-лицевой и скелетно-мышечной форме быстро развиваются нарушения дыхания и сердечной деятельности.
При генерализованной форме миастении в патологический процесс вовлекаются, прежде всего, мышцы краниального отдела, шеи, конечностей, туловища. Утомляемость и слабость мышц усиливаются после физической нагрузки, к концу дня. Двигательные расстройства обусловливаются преимущественным поражением мышц отделов рук, ног, слабостью мышц шеи.
При глазной форме в клинической картине доминируют глазодвигательные расстройства: птоз, односторонний или двухсторонний, двоение, косоглазие; выраженность симптомов бывает непостоянной, усиливаясь к вечеру, уменьшаясь после отдыха, отмечается своеобразный «нистагм» за счет слабости и утомления наружных мышц глаза.
При глоточно-лицевой форме миастении слабость мимических мышц сочетается со слабостью мышц гортани, мягкого неба и языка, возможно возникновение неподвижности языка, неба. Это проявляется нарушением речи (фонации и артикуляции), глотания.
Диагностика Миастении у детей:
Диагностика миастении у детей представляет значительную трудность в связи с вариабельностью клинических симптомов и особенностями обследования ребенка.
Задача клинического обследования – выявить главный признак заболевания – патологическую утомляемость мышц. Для подтверждения диагноза используются прозериновая проба, электромиография, сцинтиграфия вилочковой железы, исследование иммунного статуса.
Прозериновая проба с оценкой силы и утомляемости пораженных мышц проводится до и спустя 30 мин после внутримышечного введения 0,05% раствора прозерина в разовой возрастной дозе. Различают:
- резко положительную прозериновую пробу, когда исчезают все миастенические симптомы;
- положительную пробу – остаются только отдельные симптомы;
- слабоположительную пробу, при которой уменьшается выраженность миастенических симптомов;
- сомнительную прозериновую пробу – степень выраженности проявлений миастении изменяется незначительно;
- отрицательную прозериновую пробу – клиническая симптоматика не изменяется после введения прозерина.
О постановке диагноза миастении можно судить, имея один из первых трех вариантов прозериновой пробы.
Электрофизиологические исследования при миастении проводятся с целью определения феномена «миастенической реакции» – прогрессирующего снижения силы мышечного сокращения при стимуляции нерва. В настоящее время у детей используют глобальную электромиографию, при которой после физической нагрузки отмечается значительное снижение амплитуды, уменьшение времени электроактивности, снижение частоты токов действия. Для уточнения характера патологии тимуса исследуют не только функциональную активность тимуса, но и проводят томографию переднего средостения, пневмомедиа-стинографию, компьютерную томографию грудной клетки. Известно, что у 8-9% больных миастенией диагностируют опухоль тимуса – тимому, характеризующуюся быстрым развитием с преимущественным поражением мышц, осуществляющих акт глотания, мимических мышц.
Наряду с оценкой иммунного статуса, делают серологический анализ на определение антител к АХР, количество которых у большинства больных повышено. При локализованных формах миастении эти показатели и электрофизиологические данные могут быть не изменены, поэтому дифференциальная диагностика локализованных форм миастении достаточно сложна. Дифференциальная диагностика необходима для исключения заболеваний, в структуре которых имеет место миастенический синдром. К ним относятся ботулизм, отравление антибиотиками из группы аминогликозидов, болезнь Иценко-Кушинга, болезнь Аддисона, гипо- и гипертиреоз, полимиозит.
Лечение Миастении у детей:
В лечение миастении используют консервативные и оперативные методы.
Основу консервативной терапии составляют антихолинэстеразные препараты (АХЭП). Используют прозерин (неостигмин), калимин (пиридостигмина бромид), оксазил. Доза АХЭП подбирается индивидуально и зависит от возраста ребенка, формы заболевания, результатов прозериновой пробы, позволяющей оценить реакцию на препарат, достигнутую степень компенсации, наличие или отсутствие побочных эффектов. При выборе АХЭП учитывается свойственная им фармакокинетика:
Прозерин при подкожном введении в дозе 1-2 мл 0,05% раствора действует уже черезмин, максимальный эффект проявляется спустямин после инъекции. Продолжительность действия – 2-3 ч.
Калимин при приеме внутрь вызывает эффект черезмин, который продолжается до 5-6 ч.
Оксазил начинает действовать черезмин в течение 6-8 ч.
При нарушении глотания часто применяют сочетание АХЭП: за 30 мин до еды внутримышечно вводят 1 мл 0,05% раствора прозерина, а через 1 ч после него назначают внутрь калимин, дающий более продолжительный эффект.
В случаях выраженной передозировки АХЭП может развиться холинергический криз, который проявляется симптомами сочетанной мускариновой и никотиновой интоксикации. Возникают брадикардия, миоз, фибриллярные подергивания, повышенная саливация, схваткообразная боль в животе, рвота, понос, возбуждение, нарушение дыхания (бронхоспазм, гиперкапния). В тяжелых случаях развивается тремор, судороги и наступает смерть. В младшем возрасте (до 1 года) организм более вынослив к антихолинэстеразным средствам. Поэтому родителям необходимо быть очень внимательными и следить за проявляением побочных эффектов у ребенка. В случае холинергического криза необходима немедленная госпитализация больного ребенка. Холинергический криз развивается медленно, в течение нескольких дней, для него характерно покалывание в мышцах, ощущение спазма в горле, признаки периферической сосудистой недостаточности: бледные кожные покровы, холодные конечности, мраморность кожи.
Также у больных может наблюдаться миастенический криз, при котором утяжеление состояния больного обусловлено недостаточной дозой АХЭП. В лечении миастенического криза используют прозерин или калимин в более высоких дозах.
Некоторые лекарственные препараты утяжеляют течение миастении: антибиотики (неомицин, стрептомицин, те-трациклины), d-пеницилламин, гидантоин, магнийсодержащие препараты, хинин, хинидин, клоназепам, а также миорелаксанты, полимиксин, канамицин, гентамицин, линкомицин, клиндамицин, фенитоин, карбонат лития, трициклические антидепрессанты, новопассит.
При тяжелой форме миастении назначают кортикостероидные препараты: преднизолон 1,5 мг/кг в сутки и более, ориентируясь на клиническое состояние больного.
Заслуживает внимания метод энтеросорбции, в частности с использованием полифепана. Данный метод приводит к улучшению нервно-мышечной передачи. Имеются данные об успешном применении у детей с миастенией плазмафереза как компонента комплексной терапии.
При миастении могут быть использованы иммуноглобулины для внутривенного введения (интраглобин, иммуноглобулин, пентаглобин). Их вводят в доземг/кг в сутки в течение 2-5 дней. Индивидуальная непереносимость иммуноглобулинов может проявляться головной болью, тошнотой, головокружением, рвотой, диареей, тахикардией, цианозом, одышкой, гипертермией, ознобом, повышенным потоотделением, болью в спине, миалгией и др. Перечисленные симптомы могут проявляться через 30 мин после начала инфузии и наблюдаться в течение первых суток.
Оперативное лечение миастении в детском возрасте заключается в тимэктомии (удаление вилочковой железы), которая при миастении дает положительный эффект в 70-80% случаев. Основные показания к тимэктомии:
- наличие тимомы или кисты тимуса;
- недостаточная эффективность лечения с помощью АХЭП;
- резистентность к проводимой терапии, несмотря на высокие дозы АХЭП;
- непереносимость АХЭП.
У детей оперативное лечение показано при тяжелых и средней тяжести формах заболевания. Лучшие результаты наблюдают у больных с наименьшей продолжительностью заболевания. Дети, которые были больны миастенией менее 5 лет, имеют улучшение после операции в 98% случаев, больше 5 лет – только в 71%.
После операции тимэктомии больных переводят в диспансер. Лечение продолжается сниженной дозой препаратов АХЭП, дополнительно назначают витамины группы В, витамин Е, АТФ. Длительное наблюдение за детьми с миастенией, перенесшими операцию тимэктомию, показывает, что отличные и хорошие результаты (полное выздоровление, значительное улучшение) наблюдаются у 75-80% больных.
Кортикостероиды (преднизолон и др.) назначают:
- в дооперационном периоде – при тяжелой форме миастении;
- в послеоперационном периоде – при отсутствии эффекта тимэктомии или при ухудшении состояния в ближайшем или отдаленном периоде. Существуют различные схемы кортикостероидной терапии, которые разрабатываются и назначаются индивидуально, в зависимости от тяжести протекания болезни.
В настоящее время, несмотря на достигнутые успехи в терапии, продолжается совершенствование методов лечения миастении у детей.
Профилактика Миастении у детей:
Если ребенку поставлен диагноз миастения, ему запрещены чрезмерные физические нагрузки и долгое нахождение на солнце. Питание ребенка должно содержать малокалорийные продукты. В целях профилактики необходимо принимать препараты, укрепляющие иммунитет. Во время лечения и профилактики при миастении есть ряд препаратов, которые не показаны к применению, к ним относятся: нейролептики, мочегонные, транквилизаторы, антибиотики групп фторохинолонов. Поэтому при выборе лекарственного средства стоит быть осторожными.
К каким докторам следует обращаться если у Вас Миастения у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Миастении у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Телефон нашей клиники в Киеве: (+3(многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Миастения у детей
Миастения у детей
- Союз педиатров России
Оглавление
Ключевые слова
- Патологическая утомляемость,
- Слабость лицевой мускулатуры,
- Офтальмологические нарушения,
- Бульбарные расстройства,
- Нарушение витальных функций,
- Антихолинэстеразные препараты.
Список сокращений
Термины и определения
Новые и узконаправленные профессиональные термины в настоящих клинических рекомендациях не используются
1. Краткая информация
1.1 Определение
Миастения – это аутоиммунное заболевание, характеризующееся нарушением нервно-мышечной передачи и проявляющееся слабостью и патологической утомляемостью скелетных (поперечнополосатых) мышц.
1.2 Этиология и патогенез
По современным представлениям, основой патогенеза миастении является аутоиммунная реакция, вызванная связыванием антителами ацетилхолиновых рецепторов (АХР) постсинаптических мембран поперечно-полосатой мускулатуры. Число этих рецепторов значительно снижено под воздействием этих аутоантител. В некоторых случаях при аутоиммунной миастении гравис (МГ) не выявляются антитела (АТ) к АХР, и такая форма получила название серонегативной миастении гравис (СН-МГ). Термин «серонегативная» является неточным по отношению к группе пациентов, включая детей, имеющих АТ класса IgG к мышечной специфической рецепторной тирозинкиназе (МуСК). Эта форма получила название МуСК-МГ. Хотя получены убедительные доказательства патогенности АХР АТ, патогенетическая роль МуСК АТ остается неясной. Могут выявляться и другие АТ, роль которых не установлена, в том числе к титину, рианодиновым рецепторам и внутриклеточному АХР-связанному протеину рапсину.
Механизм, запускающий выработку АТ, остается неизвестным. На роль вилочковой железы указывает сочетание АХР и лимфоидной гиперплазиии опухолей тимуса, а также эффективность тимэктомии. При МуСК-МГ если и выявляются, то лишь небольшие гистологические изменения тимуса. На наличие генетической предрасположенности указывает относительно часто наблюдающиеся клинические и электромиографические (ЭМГ) симптомы у родственников больного и часто встречающиеся отдельные группы антигенов главного комплекса тканевой совместимости человека (HLA).
Отмечается сочетание с другими аутоиммунными расстройствами, особенно с патологией щитовидной железы (гипер- или гипотиреоз), ревматоидным артритом, красной волчанкой и диабетом. По данным некоторых исследователей злокачественные опухоли отмечались у 5% детей.
1.3 Эпидемиология
Миастения — заболевание относительно редкое, хотя существует достаточно оснований считать, что наблюдают его значительно чаще, чем считали ранее. Наиболее предрасположены к заболеванию лица с фенотипом HLA-B3, HLA-B8, HLA-DW3. Распространенность миастении составляет 0,5 – 5 случаев на 100 тыс. населения, однако в настоящее время имеется тенденция к увеличению числа больных и составляет 10 – 24 случая на 100 тыс. населения. Миастения может дебютировать в любом возрасте, начиная с раннего детства (чаще у девочек и в подростковом возрасте) и заканчивая глубокой старостью. Дети и подростки до 17 лет составляют 9-15% больных миастенией. В детском возрасте чаще встречается ювенильная форма миастении. Приблизительно у 5-20% младенцев (по данным разных источников), рожденных больными миастенией матерями, развивается транзиторная неонатальная миастения (ТНМ), обусловленная переносом через плацентарный барьер антител к ацетилхолиновым рецепторам (АХР) от матери. Наиболее высокая заболеваемость отмечается в 2-х возрастных категориях:лет (в этот период чаще болеют женщины) илет (в этот период мужчины и женщины поражаются одинаково часто). Средний возраст начала болезни у женщин — 26 лет, у мужчин — 31 год.
1.4 Кодирование по МКБ-10
G70 – Myasthenia gravis и другие нарушения нервно-мышечного синапса: исключены: ботулизм (A05.1), транзиторная неонатальная Myasthenia gravis (P94.0)
G70.0 – Myasthenia gravis
G70.1 — Токсические нарушения нервно-мышечного синапса
G70.2 — Врожденная или приобретенная миастения
G70.8 — Другие нарушения нервно-мышечного синапса
G70.9 — Нарушение нервно-мышечного синапса неуточненное
1.5 Примеры диагнозов
- Миастения, генерализованная форма, прогрессирующее течение, средняя степень тяжести, достаточная компенсация на фоне АХЭП.
- Миастения, локальная (глазная) форма, стационарное течение, легкая степень тяжести, хорошая компенсация на АХЭП.
- Миастения, генерализованная форма с дыхательными нарушениями, прогрессирующее тяжелое течение с недостаточной компенсацией на АХЭП.
1.6 Классификация
Существует несколько классификаций миастении. Наиболее распространена в мире классификация по Оссерману (принята как международная в 1959г. в Лос-Анжелесе, модифицирована в 1971г. Оссерманом и Дженкиным).
- Миастения новорожденных
- Врожденная миастения
- Доброкачественная с офтальмопарезом или офтальмоплегией
- Семейная детская
- Юношеская миастения
В.С. Лобзиным в 1960г. предложена классификация миастении по течению патологического процесса:
1 – острое начало с быстрым развитием симптомокомплекса и в дальнейшем медленное прогрессирование,
2 – острое начало, более длительное (от 3 месяцев до 1 года) развитие синдрома, течение с ремиссиями, но неуклонным прогрессирование,
3 – постепенное начало, медленное развитие на протяжении нескольких лет и последующее медленно прогрессирующее течение,
4 – начало с ограниченной группы мышц и медленное прогрессирование.
В 1965 г. А.Г. Пановым, Л.В. Довгелем и В.С. Лобзиным разработана классификация миастении по локализации патологического процесса с учетом нарушения витальных функций (нарушением дыхания и сердечной деятельности):
а) без нарушения витальных функций, б) с нарушением дыхания и сердечной деятельности;
а) лицевая форма (глазная, глоточно-лицевая), б) скелетно-мышечная форма: без нарушения дыхания и с нарушением дыхания.
Наиболее удобна для практического врача классификация, предложенная в 1965 г. Б.М. Гехтом. В ней учитывается характер течения заболевания, степень генерализации миастенического процесса, тяжесть двигательных расстройств и степень их компенсации на фоне ингибиторов ацетилхолинэстеразы (АХЭ), что помогает достаточно полно и точно сформулировать диагноз.
По характеру течения:
1. Миастенические эпизоды (однократный или ремиттирующее течение) – преходящие двигательные нарушения с полным регрессом (10-12%).
2. Миастенические состояния (т.е. стационарное течение) – стационарная непрогрессирующая форма в течение многих лет (13%).
3. Прогрессирующее течение – неуклонное прогрессирование заболевания (50-48%).
4. Злокачественная форма – острое начало и быстрое нарастание нарушения функции мышц (25%).
Формы переходят друг в друга.
– локальные (ограниченные) процессы: глазные, бульбарные, лицевые, краниальные, туловищные;
– генерализованные процессы: генерализованные без бульбарных нарушений, генерализованные и генерализованные с нарушением дыхания.
По степени тяжести двигательных расстройств:
По степени компенсации двигательных нарушений на фоне ингибиторов ацетилхолинэстеразы (АХЭ):
2. Диагностика
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб обращают внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных или полных ремиссий, обратимость симптомов на фоне приема ингибиторов АХЭ (на время их действия) и на фоне адекватной иммуносупрессивной терапии.
2.2 Физикальное обследование
Клинический осмотр должен включать исследование общего неврологического статуса, а также проверку силы произвольных мышц лица, шеи, туловища и конечностей до и после нагрузки (оценка силы в баллах, где 0 – отсутствие силы, 5 – сила данной группы мышц здорового человека). Одним из самых важных клинических тестов для диагностики миастении является наличие синдрома патологической мышечной утомляемости: нарастание симптомов после нагрузки. Например, нарастание птоза, глазодвигательных нарушений при фиксации взора, после зажмуривания; снижение силы в отдельных группах мышц после повторных активных движений в исследуемой конечности, приседаний или ходьбы; появление или нарастание речевых нарушений при счете, чтении вслух и т.д. При этом не выявляется никаких симптомов органического поражения нервной и нервно-мышечной системы (при отсутствии сопутствующих заболеваний): нет нарушений в рефлекторной и координаторной сфере, сохранена чувствительность, в типичных случаях отсутствуют мышечные атрофии, сохранен мышечный тонус.
Ювенильная аутоиммунная миастения гравис (ЮМГ)
Симптомы болезни могут развиваться в любом возрасте старше одного года, но наиболее часто проявляются у девочек в подростковом возрасте. Начало болезни может быть постепенным или внезапным.
Клиническая картина характеризуется:
- поражением глазодвигательных мышц с диплопией, офтальмоплегией и птозом (могут быть симметричными, асимметричными или односторонними),
- слабость мышц лица (особенно круговой мышцы глаза),
- слабость проксимальных отделов конечностей,
- поражение дыхательной и ротоглоточной мускулатуры,
- глубокие сухожильные рефлексы сохранены.
При обследовании детей с развившейся дыхательной недостаточностью при отсутствии легочной патологии необходимо учитывать возможность ЮМГ, даже если отсутствуют другие симптомы этого заболевания.
Первоначально мышечная сила может быть нормальной или почти нормальной, и поэтому мышечную силу нужно оценивать до и после физической нагрузки.
Частота случаев, при которых поражение ограничено только глазодвигательными мышцами (глазная миастения), существенно отличается в различных публикациях, но, вероятно, составляет 20-50%, и до 80% у маленьких детей в Китае. МуСК-МГ чаще встречается у женщин, в клинической картине преобладает слабость глазодвигательных мышц и мышц черепа, отмечаются частые респираторные кризы. Различия между МуСК-МГ и АХР-МГ еще предстоит выяснить.
Транзиторная неонатальная форма (миастения новорожденных)
Клинические проявления включают:
- общую мышечную гипотонию,
- слабый крик,
- затрудненное дыхание и сосание,
- возможно развитие птоза,
- амимии, глазодвигательных нарушений,
- расстройств глотания, снижение глубоких рефлексов.
Врожденные миастенические синдромы более подробно представлены в приложении Г1.
Преходящий миастенический синдром, проявляющийся у таких детей в первые дни жизни и продолжающийся в течение 1-1,5 мес., обусловлен переносом через плацентарный барьер антител к АХР от матери.
- сопутствующими заболеваниями, и являются отличительным признаком состояния, называемого сейчас ВМС с эпизодическим апноэ).
Таким образом, отличием всех симптомов миастении является динамичность в течение суток, усиление после нагрузки, обратимость или уменьшение степени их выраженности после отдыха.
Миастенический криз, при котором по разным причинам происходит резкое ухудшение состояния с нарушением витальных функций. Молекулярной основой миастенического криза, вероятно, является резкое уменьшение количества функционирующих АХР вследствие массированной атаки их аутоантителами. Часто миастенический криз провоцируется бронхолегочной инфекцией, а в ряде случаев на фоне криза развивается пневмония, и тогда нарушения дыхания могут носить смешанный характер.
Дифференцировать миастенический криз от других тяжелых состояний, сопровождающихся респираторными расстройствами, можно по наличию:
- бульбарного синдрома,
- гипомимии,
- птоза,
- асимметричного наружного офтальмопареза,
- слабости и утомляемости мышц конечностей и шеи (уменьшающихся в ответ на введение ингибиторов АХЭ).
Следует отличать миастенический криз от холинергического (Приложение Г2), который развивается при избыточной дозе ингибиторов АХЭ. Общими симптомами кризов является выраженная слабость произвольной мускулатуры с нарушением дыхания и бульбарным синдромом, психомоторное возбуждение и нарушение сознания (сопор, кома).
Смешанные (миастенический + холинергический) кризы встречаются у больных миастенией при неправильном приеме и / или изначально узком диапазоне терапевтических доз ингибиторов АХЭ, а также на фоне состояний, вызывающих общую или мышечную слабость различного генеза (интеркуррентные инфекции, соматические, гормональные нарушения, прием препаратов, влияющих на сократительную функцию произвольных мышц и др.).
2.3 Лабораторная диагностика
(Сила рекомендаций – 1; достоверность доказательств – С)
- Рекомендуется определение антихолинэстеразных антител.
Комментарии: Антитела к АХР выявляются у детей в пределах 60-80%. В препубертатном возрасте тест положителен примерно у 50% детей. Титр антител снижается у успешно пролеченных пациентов. Из серонегативных на антитела к АХР, около 40-50% серонегативны на антитела к МуСК. Более высокая частота наличия этих антител у детей точно не установлена, но они могут присутствовать при начале заболевания в раннем детском возрасте.
2.4 Инструментальная диагностика
- Рекомендуется проведение итерационной стимуляции нерва (ИСН), что позволяет выявить электрическую нервно-мышечную блокаду.
(Сила рекомендаций – 1; достоверность доказательств – С)
Комментарии: Этот тест вызывает стресс, особенно у маленьких детей, и поэтому должен выполняться щадяще. Технические трудности у маленьких детей также составляют проблему, и поэтому перед тем, как объявлять тест положительным, нужно быть полностью уверенным, что снижение амплитуды происходит по миастеническому типу. Суммарные потенциалы действия мышцы фиксируются с поверхностных электродов, лучше над слабой мышцей; частота стимуляции нерва 3Гц и 5Гц. Снижение амплитуды более чем на 10% в промежутке с третьего по пятый потенциал считается положительным результатом. Одноволоконная ЭМГ, позволяющая выявить усиленное «дрожание» при сокращении пар волокон, является более чувствительным, чем классическая ИСН, но трудновыполнимым у детей методом. Нормальная ИСН не исключает диагноза ЮМГ.
- Рекомендуется в диагностически сложных случаях проводится морфологическое исследование мышечного биоптата (световая, электронная микроскопия, гистохимическое, иммуногистохимическое, иммунофлуоресцентное и другие виды визуального изучения нервно-мышечного соединения и окружающих его тканей).
Комментарии: Основные качественные и количественные изменения при миастении обнаруживаются в постсинаптической мембране, которая содержит АХР, и в стадии развернутой клинической картины число АХР снижается до 10-30% от нормальных значений, падает их плотность.
2.5 Иная диагностика
(Сила рекомендаций – 1; достоверность доказательств – С)
- Рекомендуется применение антихолинэстеразных препаратов — проба с ингибиторами АХЭ: неостигминаметилсульфат (код АТХ: N07AA01), пиридостигмина гидрохлорид (код АТХ: N07AA02). После введения одного из этих препаратов эффект наблюдается в одной или нескольких ослабленных мышцах. Наиболее часто проводится проба с неостигминаметилсульфатом. Доза подбирается индивидуально из расчета 0,125 мг/кг массы тела (ориентировочно: 1,5мл 0,05% раствора – при массе тела до 70кг и 2мл – при массе тела более 70кг или при выраженной генерализованной слабости мышц конечностей без учета массы тела). Можно избрать любой парентеральный путь введения препарата, но обычно делается подкожная инъекция. Оценивается действие препарата черезминут.
Комментарии: Положительной полной проба считается при восстановлении мышечной силы до 5 баллов с компенсацией бульбарных и глазодвигательных нарушений, положительной неполной – при нарастании силы на 1-2 балла, но без полного ее восстановления и (или) сохранении редуцированного бульбарного или глазодвигательного дефекта. Частичная компенсация заключается в избирательном действии ингибиторов АХЭ на отдельные группы мышц, как правило, с нарастанием силы произвольных мышц на 1балл. Выделяется сомнительная прозериновая проба, когда отмечается некоторая положительная динамика в отношении отдельных симптомов (уменьшение птоза на 1-2мм, некоторое увеличение объема движений глазных яблок, несколько более звонкий голос, впечатление о некотором нарастании силы мышц конечностей и т.д.
- Рекомендуется введение внутримышечное или подкожное неостигмина метилсульфата при подозрении на транзиторную неонатальную форму (миастения новорожденных).
Комментарии: Клинические симптомы позволяют поставить правильный диагноз, если известно о существовании миастении у матери, но заболевание матери может быть недиагностированным или протекать бессимптомно. Диагноз подтверждается при внутримышечном или подкожном введении Неостигмина метилсульфата (Код АТХ: N07AA01); ИСН также может выполняться для подтверждения диагноза, но ее проведение в этом возрасте технически затруднительно и болезненно. Для диагностики, а затем и для лечения, предпочтительнее применять Неостигмина метилсульфат (код АТХ: N07AA01, Прозерин), особенно перед кормлением, так как его эффект продолжается дольше, что дает больше времени для обследования (например, разовая доза 0,1 мг перед кормлением, а дополнительные дозы — по мере необходимости).
Если диагноз миастении вызывает сомнения, требуется динамическое наблюдение, проведение пробного курса ингибиторов АХЭ ( пиридостигмина гидрохлорид в сочетании с препаратами калия – только строго избегая холинергических реакций), повторное клиническое и электромиографическое (ЭМГ) обследование.
Антихолинэстеразный тест и ИСН не обладают высокой чувствительностью и специфичностью, тогда как наличие антител к АХР специфично для миастении гравис.
2.6 Дифференциальная диагностика.
Диагноз миастения ставится на основании совокупности клинических данных, результатов инструментальных обследований. Главное отличие миастении от других форм патологии — динамичность симптомов и положительная реакция на введение антихолинэстеразных препаратов.
Необходимо исключение следующих заболеваний:
— окулофарингеальная мышечная дистрофия;
— конгенитальные миастенические синдромы и др.
Бульбарные проявления миастении следует дифференцировать с сосудистыми и опухолевыми поражениями мозга, для которых типичны выраженные общемозговые симптомы, а также отсутствие динамичности нарушений и реакции на введение антихолинэстеразных препаратов.
Иногда значительные трудности возникают при дифференциальной диагностике миастении и бокового амиотрофического склероза (БАС), при котором в некоторых случаях возможны не только клинические симптомы миастении, но и нарушения нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов. В таких случаях правильный диагноз можно поставить только после проведения ЭМГ, выявляющей признаки денервации и реиннервации, а также наличие большого количества потенциалов фасцикуляций, характерных для БАС. Дыхательные расстройства и кризы при миастении следует дифференцировать с синдромом Гийена-Барре (СГБ), для которого характерна арефлексия, нарушение состава ликвора, отсутствие нарушений нервно-мышечной передачи и реакции на введение антихолинэстеразных препаратов.
Слабость мышц туловища и конечностей у больных миастенией дифференцируют с различными формами врождённых и приобретённых миопатий.
Миопатический процесс, как правило, характеризуется отличным от миастении характером распределения двигательных расстройств: отсутствием (за редким исключением) признаков поражения экстраокулярной и бульбарной мускулатуры, дыхательных нарушений; чаще сопровождается снижением или отсутствием сухожильных рефлексов, различной степенью выраженности мышечных атрофий.
Клинические симптомы, напоминающие миастению, возможны и при других формах нарушения нервно-мышечной передачи, таких, как синдром Ламберта-Итона и ботулизм. И если для синдрома Ламберта-Итона не типичны экстраокулярные, бульбарные и дыхательные нарушения, то именно они составляют основное клиническое ядро ботулизма. Характерные для синдрома Ламберта-Итона слабость и утомляемость мышц туловища и конечностей при ботулизме выявляют относительно редко. Для обеих форм характерна гипо- или арефлексия.
Эффект от введения антихолинэстеразных препаратов при синдроме Ламберта-Итона минимальный, а при ботулизме отсутствует. Нарушения нервно-мышечной передачи характеризуются снижением исходной амплитуды М-ответа и её существенным увеличением в процессе высокочастотной стимуляции (инкремент) или после максимального произвольного усилия.
3. Лечение
3.1 Консервативное лечение
- Рекомендовано применение блокаторов холинэстеразы.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Эти препараты увеличивают период полураспада выброшенного в синаптическую щель ацетилхолина (АХ) путем ингибирования его гидролиза ацетилхолинэстеразой, увеличивая таким образом вероятность того, что молекулы АХ достигнут рецепторов, число которых снижено.
- Пиридостигмина бромид ж, вк (код ATX:N07AA02) в дозе до 7 мг/кг/день назначается в 3-5 приемов.
- Неостигмина метилсульфат ж, вк (код АТХ:N07AA01) начальная доза составляет 0,2-0,5 мг/кг каждые четыре часа у детей до 5 лет и 0,25 мг/кг у более старших детей, максимальная разовая доза 15 мг.
- Рекомендовано применение кортикостероидов.
(Сила рекомендаций – 2; достоверность доказательств – В)
Комментарии: ГКС вызывают ремиссию у большинства детей с ЮМГ. Преднизолон ж ,вк (код АТХ: Н02АВ06) назначается в дозе 1-2 мг/кг/день до достижения устойчивого эффекта, после чего препарат постепенноотменяют.
- Рекомендовано применение других видов длительной иммунотерапии.
(Сила рекомендаций – 1; достоверность доказательств – В)
- Азатиоприн ж ,вк (код АТХ:L04АХ01) можно применять в комбинации со стероидами или отдельно. Начальная доза 50 мг/сутки и до 100–200 мг/сутки вместе с поддерживающей дозой Преднизолона.
- Циклоспорин ж (код АТХ: L04AD01) можно назначать при непереносимости Азатиоприн.
- Циклофосфамид ж, вк (Код АТХ: L01AA01) применяется при очень тяжелом течение болезни.
- Пульс-терапия высокими дозами Метилпреднизолона ж ,вк (H02AB04) применяется у детей с рефрактерным течением болезни.
- Рекомендовано применение замещения плазмы.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Плазмаферез применяется для лечения миастенических кризов, а также для пре- и после операционной поддержки. Проводится внутривенное введение иммуноглобулинов класса G – иммуноглобулин человека нормальный ж ,вк (код АТХ: J06BA02, Иммуноглобулин человека нормальный) Эффект наблюдается через 3-4 дня и сохраняется до 3-х месяцев.
3.2 Хирургическое лечение
- Рекомендовано применение тимэктомии.
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: применяется в качестве основного метода длительного лечения, особенно у детей с высоким риском развития осложнений лечения блокаторами ХЭ или кортикостероидами, либо других видов иммунотерапии.
Показаниями к оперативному лечению являются:
а) злокачественные формы;
б) прогрессирующая форма;
в) миастеническое состояние в зависимости от степени выраженности дефекта.
При локальных формах к оперативному лечению подходят избирательно.
Противопоказания к тимэктомии:
- тяжелые декомпенсированные соматические заболевания;
До оперативного лечения обязательна предоперационная подготовка:
- общеукрепляющая терапия;
- проведение лечебного плазмафереза;
- при необходимости — курс глюкокортикостероидной терапии.
4. Реабилитация
5. Профилактика и диспансерное наблюдение
5.1 Профилактика
Профилактика не разработана.
5.2 Ведение пациентов
Ведение пациентов с миастенией в амбулаторно-поликлинических условиях должно включать:
- ЭКГ всем детям 1 раз в 3 месяц.
- ?УЗИ брюшнойполости, сердца, почек – 1 раз в 6 месяц.
- ?рентгенологическое обследование грудной клетки, суставов, при необходимости позвоночника, крестцово-подвздошных сочленений — 1 раз в 6 месяц.
- ?эзофагогастродуоденоскопия с биопсией на Helicobacter pylori и морфологической диагностикой — 1 раз в 6 месяцев для исключения эрозивных, язвенных процессов и гастропатий.
- ?при обострении — УЗИвнутренних органов и рентгенография органов грудной клетки, ЭКГ и другие необходимые инструментальные методы обследования (КТ, МРТ) по показаниям:
- пациентам с миастенией реакция Манту проводится, обследование на туберкулез осуществляется под контролем фтизиатра
- при выявлении положительных туберкулиновых проб (папула > 5 мм) направление на консультацию к врачу – фтизиатру для решения вопроса о проведения Диаскин-теста или туберкулиновых проб с разведением и проведении специфической терапии
Ведение пациента, получающего иммуносупрессивную терапию
- осмотр врача-невролога – 1 раз в месяц;
- ?клинический анализ крови (концентрация гемоглобина, число эритроцитов, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) — 1 раз в 2 недели;
- ?при снижении числалейкоцитов, эритроцитов, тромбоцитов ниже нормы — иммунодепрессанты отменитьна 5–7 дней. После контрольного анализа крови при нормализации показателей — возобновить прием препарата;
- ?анализ биохимических показателей (общий белок, белковые фракции, концентрациямочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) — 1 раз в 2 неделю:
- при повышении уровня мочевины, креатинина, трансаминаз, билирубина выше нормы — иммунодепрессанты отменитьна 5–7 дней. Возобновить прием препарата после восстановления биохимических показателей;
- ?анализ иммунологических показателей (концентрация Ig A, M, G; СРБ, РФ, АНФ) —1 раз в 3 месяца.
Ведение пациента с миастенией, получающего антихолинэстеразные препараты
- ?осмотр врача невролога 1 раз в месяц;
- ? клинический анализ крови (концентрация гемоглобина, число эритроцитов, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) — 1 раз в 2 недели;
- ?анализ биохимических показателей (общий белок, белковые фракции, концентрациямочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) — 1 раз в 2 недели;
- ? анализ иммунологических показателей (концентрация Ig A, M, G; СРБ, РФ, АНФ) —1 раз в 3 месяца;
- плановая госпитализация 2 раза в год для проведения полного обследования и при необходимости коррекции терапии.
Пациентам с миастенией показано оформление статуса «ребенок – инвалид». В периоды обострения болезни необходимо обеспечение обучения на дому. В стадии ремиссии болезни рекомендуются занятия ЛФК со специалистом, знакомым с особенностями патологии. При посещении школы? занятия физкультурой в общей группе не показаны. Больным миастенией противопоказаны профилактические прививки, введение ? глобулина.
Пациенты с диагнозом миастения должны находиться под постоянным диспансерным наблюдением педиатра и невролога. Детям с данной патологией показано комплексное обследование в условиях специализированного круглосуточного/дневного стационара, средняя продолжительность госпитализации – 21 день. Целесообразно проведение курсов реабилитационной терапии сроком не менеедней 2-3 раза в год под наблюдением невропатолога, врача-физиотерапевта и специалиста ЛФК.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Исходы и прогноз
Наиболее тяжелое течение миастении наблюдается у детей с множественными стигмами дисэмбриогенеза (костно-мышечные дисплазии, аномалии развития центральной нервной системы), нейроэндокринными нарушениями (диэнцефально-височные пароксизмальные состояния, задержка роста и полового созревания на фоне гипопитуитарного синдрома, приобретенный гирсутизм и другие), незрелостью лимфоидной системы носоглотки (аденоиды, тонзиллит, фарингит), бронхообструктивным синдромом и другой сопутствующей патологией. У мальчиков с дебютом заболевания в препубертатный период и регрессом симптомов миастении к концу пубертата, как правило, отмечаются стойкие ремиссии.
Выбор правильной тактики лечения позволяет достигнуть положительного эффекта (стойкая полная или частичная ремиссия на фоне приема медикаментозных средств или без них) у 80 % больных миастенией. Однако, до настоящего времени не существует методов прогноза течения заболевания и специфических патогенетических методов лечения миастении.
Критерии оценки качества медицинской помощи
Таблица 1 — Организационно-технические условия оказания медицинской помощи.